Nove publikacije
Sustav isporuke lijekova zatvorene petlje mogao bi poboljšati kemoterapijsko liječenje
Posljednji pregledao: 02.07.2025

Svi iLive sadržaji medicinski se pregledavaju ili provjeravaju kako bi se osigurala što je moguće točnija činjenica.
Imamo stroge smjernice za pronalaženje izvora i samo povezujemo s uglednim medijskim stranicama, akademskim istraživačkim institucijama i, kad god je to moguće, medicinski pregledanim studijama. Imajte na umu da su brojevi u zagradama ([1], [2], itd.) Poveznice koje se mogu kliknuti na ove studije.
Ako smatrate da je bilo koji od naših sadržaja netočan, zastario ili na neki drugi način upitan, odaberite ga i pritisnite Ctrl + Enter.
Kada se pacijenti oboljeli od raka podvrgavaju kemoterapiji, doze većine lijekova izračunavaju se na temelju tjelesne površine pacijenta. To se procjenjuje pomoću jednadžbe koja uzima u obzir visinu i težinu pacijenta. Ova je jednadžba formulirana 1916. godine na temelju podataka samo devet pacijenata.
Ovaj pojednostavljeni pristup doziranju ne uzima u obzir druge čimbenike i može rezultirati time da pacijentu bude dano previše ili premalo lijeka. Kao rezultat toga, neki pacijenti mogu iskusiti nepotrebnu toksičnost ili nedovoljnu učinkovitost kemoterapije koju primaju.
Kako bi poboljšali točnost doziranja kemoterapije, inženjeri s MIT-a razvili su alternativni pristup koji omogućuje personalizaciju doze za svakog pacijenta. Njihov sustav mjeri količinu lijeka u tijelu pacijenta i te podatke unosi u kontroler koji može prilagoditi brzinu infuzije u skladu s tim.
Ovaj pristup mogao bi pomoći u kompenzaciji razlika u farmakokinetici lijekova uzrokovanih sastavom tijela, genetskom predispozicijom, toksičnošću organa izazvanom kemoterapijom, interakcijama s drugim lijekovima i hranom te cirkadijalnim varijacijama enzima odgovornih za razgradnju kemoterapijskih lijekova, kažu istraživači.
„Prepoznavanjem napretka u razumijevanju metabolizma lijekova i primjenom inženjerskih alata za pojednostavljenje personaliziranog doziranja, vjerujemo da možemo pomoći u transformaciji sigurnosti i učinkovitosti mnogih lijekova“, rekao je Giovanni Traverso, izvanredni profesor strojarstva na MIT-u, gastroenterolog u bolnici Brigham and Women's i glavni autor studije.
Louis DeRidder, diplomirani student na MIT-u, glavni je autor rada objavljenog u časopisu Med.
Kontinuirano praćenje
U ovoj studiji, istraživači su se usredotočili na lijek pod nazivom 5-fluorouracil, koji se koristi za liječenje kolorektalnog karcinoma i drugih vrsta raka. Lijek se obično primjenjuje tijekom 46 sati, a njegova doza određuje se pomoću formule na temelju visine i težine pacijenta, što daje procjenu površine tijela.
Međutim, ovaj pristup ne uzima u obzir razlike u sastavu tijela koje mogu utjecati na način distribucije lijeka u tijelu ili genetske varijacije koje utječu na način njegovog metaboliziranja. Ove razlike mogu dovesti do štetnih nuspojava ako se da previše lijeka. Ako se ne da dovoljno lijeka, možda neće ubiti tumor kako se očekuje.
„Ljudi s istom tjelesnom površinom mogu imati vrlo različite visine i težine, različitu mišićnu masu ili različitu genetiku, ali sve dok visina i težina uvrštene u tu jednadžbu daju istu tjelesnu površinu, njihova je doza identična“, kaže DeRidder, doktorand na programu medicinskog inženjerstva i medicinske fizike na Harvard-MIT programu za zdravstvene znanosti i tehnologiju.
Drugi faktor koji može promijeniti količinu lijeka u krvi u bilo kojem trenutku je cirkadijalna varijacija enzima zvanog dihidropirimidin dehidrogenaza (DPD), koji razgrađuje 5-fluorouracil. Ekspresija DPD-a, kao i mnogih drugih enzima u tijelu, regulirana je cirkadijalnim ritmom. Dakle, razgradnja 5-FU pomoću DPD-a nije konstantna, već varira ovisno o dobu dana. Ovi cirkadijalni ritmovi mogu rezultirati deseterostrukom varijacijom količine 5-FU u krvi pacijenta tijekom infuzije.
„Korištenjem tjelesne površine za izračun doze kemoterapije, znamo da dvije osobe mogu imati vrlo različite toksičnosti 5-fluorouracila. Jedan pacijent može imati cikluse liječenja s minimalnom toksičnošću, a zatim ciklus s užasnom toksičnošću. Nešto se promijenilo u načinu na koji je pacijent metabolizirao kemoterapiju iz jednog ciklusa u drugi. Naša zastarjela metoda doziranja ne obuhvaća te promjene i pacijenti pate zbog toga“, kaže Douglas Rubinson, klinički onkolog u Dana-Farber Cancer Instituteu i autor rada.
Jedan od načina za kompenzaciju varijabilnosti u farmakokinetici kemoterapije je strategija koja se naziva terapijsko praćenje lijekova, u kojoj pacijent daje uzorak krvi na kraju jednog ciklusa liječenja. Nakon što se taj uzorak analizira na koncentracije lijeka, doza se može prilagoditi, ako je potrebno, na početku sljedećeg ciklusa (obično dva tjedna za 5-fluorouracil).
Pokazalo se da ovaj pristup dovodi do boljih ishoda za pacijente, ali nije široko korišten za kemoterapije poput 5-fluorouracila.
Istraživači s MIT-a željeli su razviti sličnu vrstu praćenja, ali na automatiziran način koji bi omogućio personalizaciju doziranja lijekova u stvarnom vremenu, što bi moglo dovesti do boljih ishoda za pacijente.
U njihovom sustavu zatvorene petlje, koncentracije lijekova mogu se kontinuirano pratiti, a te se informacije koriste za automatsko prilagođavanje brzine infuzije kemoterapijskog lijeka kako bi se doza održala unutar ciljanog raspona.
Ovaj sustav zatvorene petlje omogućuje personalizaciju doziranja lijekova kako bi se uzeli u obzir cirkadijalni ritmovi razina enzima koji metaboliziraju lijekove, kao i sve promjene u farmakokinetici pacijenta od posljednjeg liječenja, poput toksičnosti organa uzrokovane kemoterapijom.
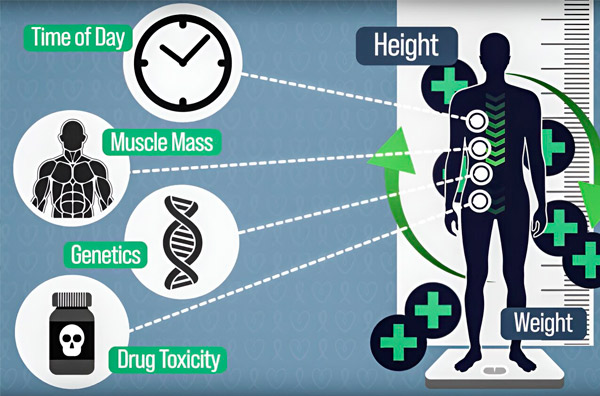
Kako bi doziranje kemoterapije bilo preciznije, inženjeri s MIT-a razvili su način kontinuiranog mjerenja količine lijeka u tijelu pacijenta tijekom višesatne infuzije. To će pomoći u kompenzaciji razlika uzrokovanih sastavom tijela, genetikom, toksičnošću lijekova i cirkadijalnim oscilacijama. Izvor: Ljubaznošću istraživača.
Novi sustav koji su razvili istraživači, poznat kao CLAUDIA (Closed-Loop AUTOmated Drug Infusion regulator), koristi komercijalno dostupnu opremu za svaki korak. Uzorci krvi uzimaju se svakih pet minuta i brzo se pripremaju za analizu. Koncentracija 5-fluorouracila u krvi se mjeri i uspoređuje s ciljanim rasponom.
Razlika između ciljane i izmjerene koncentracije unosi se u kontrolni algoritam, koji zatim prilagođava brzinu infuzije prema potrebi kako bi se doza održala unutar raspona koncentracija pri kojima je lijek učinkovit i netoksičan.
„Razvili smo sustav u kojem možemo kontinuirano mjeriti koncentraciju lijeka i prilagođavati brzinu infuzije kako bismo održali koncentraciju lijeka unutar terapijskog prozora“, kaže DeRidder.
Brzo podešavanje
U testovima na životinjama, istraživači su otkrili da korištenjem CLAUDIE mogu održati količinu lijeka u cirkulaciji tijela u ciljanom rasponu oko 45 posto vremena.
Razina lijeka u životinja koje su primale kemoterapiju bez CLAUDIA-e ostala je u ciljanom rasponu u prosjeku samo 13 posto vremena. Istraživači u ovoj studiji nisu testirali učinkovitost razina lijekova, ali smatra se da održavanje koncentracija u ciljanom rasponu rezultira boljim ishodima i manjom toksičnošću.
CLAUDIA je također uspjela održati dozu 5-fluorouracila u ciljanom rasponu čak i kada je primijenjen lijek koji inhibira enzim DPD. Kod životinja kojima je dan ovaj inhibitor bez kontinuiranog praćenja i prilagođavanja, razine 5-fluorouracila povećale su se i do osam puta.
Za ovu demonstraciju, istraživači su ručno izvršili svaki korak procesa koristeći standardnu opremu, ali sada planiraju automatizirati svaki korak kako bi se praćenje i prilagodba doze mogli obavljati bez ljudske intervencije.
Za mjerenje koncentracija lijekova, istraživači su koristili visokoučinkovitu tekućinsku kromatografiju-masenu spektrometriju (HPLC-MS), tehniku koja se može prilagoditi za detekciju gotovo bilo koje vrste lijeka.
„Vidimo budućnost u kojoj možemo koristiti CLAUDIA za bilo koji lijek koji ima odgovarajuća farmakokinetička svojstva i koji se može detektirati HPLC-MS-om, što omogućuje personalizirano doziranje za mnoge različite lijekove“, kaže DeRidder.
