Nove publikacije
Novi genetski mehanizmi mogu pružiti terapijsku metu protiv glioma
Posljednji pregledao: 02.07.2025

Svi iLive sadržaji medicinski se pregledavaju ili provjeravaju kako bi se osigurala što je moguće točnija činjenica.
Imamo stroge smjernice za pronalaženje izvora i samo povezujemo s uglednim medijskim stranicama, akademskim istraživačkim institucijama i, kad god je to moguće, medicinski pregledanim studijama. Imajte na umu da su brojevi u zagradama ([1], [2], itd.) Poveznice koje se mogu kliknuti na ove studije.
Ako smatrate da je bilo koji od naših sadržaja netočan, zastario ili na neki drugi način upitan, odaberite ga i pritisnite Ctrl + Enter.
Studija iz laboratorija Shi-Yuan Cheng, doktorice znanosti, profesorice na Odjelu za neuroonkologiju Kena i Ruth Davey na Odjelu za neurologiju, identificirala je nove mehanizme koji leže u osnovi alternativnih događaja spajanja RNA u tumorskim stanicama glioma, a koji mogu poslužiti kao nove terapijske mete. Rezultati studije objavljeni su u časopisu Journal of Clinical Investigation.
„Pronašli smo drugačiji način liječenja glioma kroz prizmu alternativnog spajanja i otkrili nove ciljeve koji prethodno nisu bili identificirani, ali su važni za malignost glioma“, rekao je Xiao Song, dr. med., doktor znanosti, izvanredni profesor neurologije i glavni autor studije.
Gliomi su najčešći tip primarnog tumora mozga kod odraslih i potječu od glijalnih stanica koje se nalaze u središnjem živčanom sustavu i podupiru susjedne neurone. Gliomi su vrlo otporni na standardne tretmane, uključujući zračenje i kemoterapiju, zbog genetske i epigenetske heterogenosti tumora, što naglašava potrebu za pronalaženjem novih terapijskih ciljeva.
Prethodno istraživanje Chengovog laboratorija, objavljeno u časopisu Cancer Research, pokazalo je da je važan faktor spajanja SRSF3 značajno povišen u gliomima u usporedbi s normalnim mozgom, a SRSF3-regulirano spajanje RNA potiče rast i napredovanje glioma utječući na višestruke stanične procese u tumorskim stanicama.
Spajanje RNA je proces koji uključuje uklanjanje introna (nekodirajućih regija RNA) i spajanje eksona (kodirajućih regija) kako bi se formirala zrela molekula mRNA koja podržava ekspresiju gena u stanici.
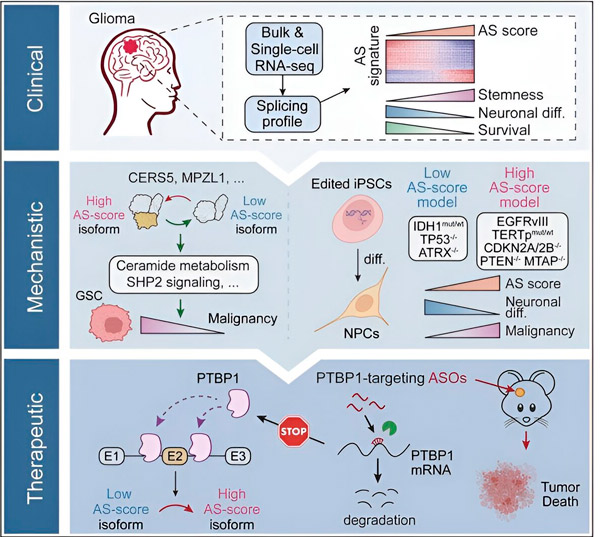
U ovoj studiji, znanstvenici su imali za cilj identificirati promjene u alternativnom spajanju u tumorskim stanicama glioma, mehanizme koji leže u osnovi tih promjena i odrediti njihov potencijal kao terapijskih ciljeva.
Koristeći računalne metode i tehnologije sekvenciranja RNA, istraživači su ispitali promjene u spajanju tumorskih stanica glioma iz uzoraka pacijenata. Kako bi potvrdili te promjene, koristili su CRISPR tehnologije uređivanja gena za uvođenje različitih mutacija gliomskih pokretača u modele glioma izvedene iz ljudskih induciranih pluripotentnih matičnih stanica (iPSC).
Otkrili su da su te promjene u spajanju pojačane varijantom receptora epidermalnog faktora rasta III (EGFRIII), za koji se zna da je prekomjerno eksprimiran u mnogim tumorima, uključujući gliome, a inhibirane su mutacijom u genu IDH1.
Istraživači su potvrdili funkciju dvaju događaja spajanja RNK koji stvaraju različite izoforme proteina s različitim aminokiselinskim sekvencama.
„Samo jedna od ovih izoformi može potaknuti rast tumora, za razliku od druge izoforme koja se normalno eksprimira u normalnom mozgu. Tumori iskorištavaju ovaj mehanizam kako bi selektivno eksprimirali izoformu koja potiče rast tumora u odnosu na izoformu normalnog mozga“, rekao je Song.
Tim je zatim analizirao uzvodne proteine koji vežu RNA i otkrio da gen PTBP1 regulira spajanje RNA koje potiče tumor u stanicama glioma. Koristeći ortotopski model glioma kod imunodeficijentnih miševa, istraživači su ciljali PTBP1 terapijom temeljenom na antisense oligonukleotidima (ASO), što je u konačnici potisnulo rast tumora.
„Naši podaci ističu ulogu alternativnog spajanja RNA u utjecaju na malignost i heterogenost glioma te njegov potencijal kao terapijske ranjivosti za liječenje odraslih glioma“, napisali su autori studije.
Sljedeći korak za istraživače je istražiti potencijal ciljanja PTBP1 kako bi se izazvao antitumorski imunološki odgovor, rekao je Song.
„Koristeći analizu sekvenciranja RNK s dugim čitanjem, otkrili smo da ciljanje PTBP1 u stanicama glioma rezultira proizvodnjom višestrukih alternativno spojenih transkripata koji nisu prisutni u normalnim tkivima. Stoga je naš sljedeći projekt otkriti može li ova izoforma generirati neke antigene kako bi imunološki sustav mogao bolje prepoznati tumor“, rekao je Song.
Song je također dodao da je njihov tim zainteresiran za analizu promjena spajanja u netumorskim stanicama pacijenata s gliomom, poput imunoloških stanica.
„Već znamo da je spajanje vrlo važno za regulaciju funkcije u stanici, tako da ne bi trebalo samo regulirati malignost tumora, već može regulirati i funkciju imunoloških stanica kako bi se utvrdilo mogu li one učinkovito ubiti rak. Stoga također provodimo neke bioinformatičke analize u imunološkim stanicama infiltriranim tumorom kako bismo vidjeli postoji li promjena u spajanju nakon što je imunološka stanica infiltrirala tumor.“
„Naš je cilj utvrditi ulogu alternativnog spajanja u oblikovanju imunosupresivnog tumorskog mikrookruženja i identificirati potencijalne ciljeve za poboljšanje učinkovitosti imunoterapija kod glioma“, rekao je Song.
