Nove publikacije
TIVDAK® odobren od strane FDA: Ciljano djelovanje na tkivni faktor kod raka vrata maternice
Posljednji pregledao: 02.07.2025

Svi iLive sadržaji medicinski se pregledavaju ili provjeravaju kako bi se osigurala što je moguće točnija činjenica.
Imamo stroge smjernice za pronalaženje izvora i samo povezujemo s uglednim medijskim stranicama, akademskim istraživačkim institucijama i, kad god je to moguće, medicinski pregledanim studijama. Imajte na umu da su brojevi u zagradama ([1], [2], itd.) Poveznice koje se mogu kliknuti na ove studije.
Ako smatrate da je bilo koji od naših sadržaja netočan, zastario ili na neki drugi način upitan, odaberite ga i pritisnite Ctrl + Enter.
Dana 29. travnja 2024. Američka Agencija za hranu i lijekove (FDA) odobrila je lijek TIVDAK® (tisotumab vedotin) tvrtke Seagen Inc., lijek usmjeren na tkivni faktor (TF), za liječenje pacijenata s rekurentnim ili metastatskim rakom vrata maternice koji je napredovao tijekom ili nakon kemoterapije. Ovo predstavlja značajan proboj u terapiji raka vrata maternice, ističući potencijal konjugata antitijela i lijekova (ADC) u onkologiji.
Mehanizam djelovanja TIVDAK-a
Tivdak je ADC koji cilja TF kombinirajući Genmab-ovo monoklonsko antitijelo protiv TF-a tisotumab sa Seagenovom ADC tehnologijom dizajniranom za ciljanje TF antigena na stanicama raka i isporuku citotoksične komponente MMAE izravno u stanice raka.
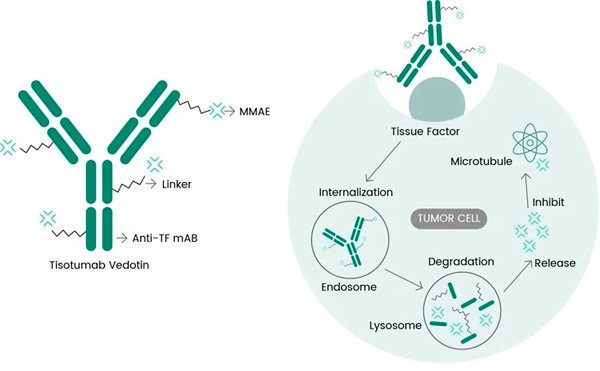
Molekularni mehanizam djelovanja tisotumaba vedotina ( https://doi.org/10.3390/ijms23073559 )
TF: Savršena meta za razvoj ADC-a
Poznato je da je TF uključen u tumorsku signalizaciju i angiogenezu te je prekomjerno eksprimiran kod velike većine pacijenata s rakom vrata maternice i mnogim drugim solidnim tumorima. Njegova sposobnost brze internalizacije nakon vezanja antitijela i minimalan utjecaj na normalnu koagulaciju krvi dodatno povećavaju njegovu prikladnost za ciljanu terapiju raka.
