TIVDAK® Odobreno od strane FDA: ciljani tkivni faktor kod raka vrata maternice
Posljednji pregledao: 14.06.2024

Svi iLive sadržaji medicinski se pregledavaju ili provjeravaju kako bi se osigurala što je moguće točnija činjenica.
Imamo stroge smjernice za pronalaženje izvora i samo povezujemo s uglednim medijskim stranicama, akademskim istraživačkim institucijama i, kad god je to moguće, medicinski pregledanim studijama. Imajte na umu da su brojevi u zagradama ([1], [2], itd.) Poveznice koje se mogu kliknuti na ove studije.
Ako smatrate da je bilo koji od naših sadržaja netočan, zastario ili na neki drugi način upitan, odaberite ga i pritisnite Ctrl + Enter.
Dana 29. Travnja 2024. Američka agencija za hranu i lijekove (FDA) u potpunosti je odobrila TIVDAK® (tisotumab vedotin) tvrtke Seagen Inc., koji cilja tkivni faktor (TF) za liječenje pacijenata s recidivirajućim ili metastatskim rakom vrata maternice koji je napredovao tijekom ili nakon kemoterapija. Ovo predstavlja značajan napredak u terapiji raka grlića maternice, ističući potencijal konjugata protutijelo-lijek (ADC) u onkologiji.
Mehanizam djelovanja TIVDAK-a
Tivdak je ADC lijek koji cilja na TF, kombinirajući Genmabovo anti-TF monoklonsko protutijelo tisotumab sa Seagenovom ADC tehnologijom dizajniranom za ciljanje TF antigena na stanice raka i isporuku citotoksičnog dijela MMAE izravno u stanice raka. p>
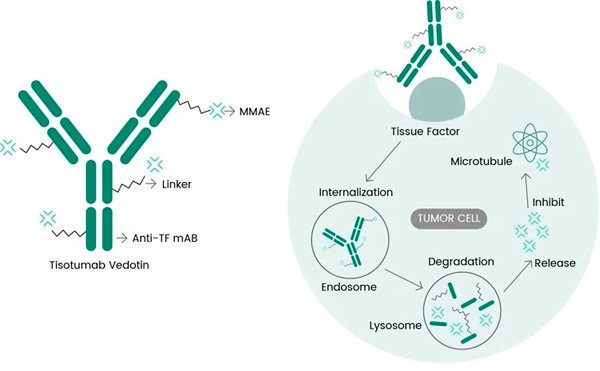
Molekularni mehanizam djelovanja tizotumaba vedotina (https://doi.org/10.3390/ijms23073559)
TF: idealna ideja za razvoj ADC
Izvjesno je da TF sudjeluje u signalnim putevima opuholevog rasta i angiogeneze i prekomjerno se ekspresira kod većine pacijenata s rakovima šejki i mnogih drugih čvrstih opuholâ. Njegova sposobnost brzog internaliziranja uključuje povezivanje antitela i minimalni učinak na normalne procese pretvaranja povećava njegovu pogodnost za ciljano ispravljenu krvnu terapiju raka.
