Mutacija gena ARID1A čini tumore osjetljivima na imunoterapiju
Posljednji pregledao: 14.06.2024

Svi iLive sadržaji medicinski se pregledavaju ili provjeravaju kako bi se osigurala što je moguće točnija činjenica.
Imamo stroge smjernice za pronalaženje izvora i samo povezujemo s uglednim medijskim stranicama, akademskim istraživačkim institucijama i, kad god je to moguće, medicinski pregledanim studijama. Imajte na umu da su brojevi u zagradama ([1], [2], itd.) Poveznice koje se mogu kliknuti na ove studije.
Ako smatrate da je bilo koji od naših sadržaja netočan, zastario ili na neki drugi način upitan, odaberite ga i pritisnite Ctrl + Enter.
Imunoterapija je posljednjih godina revolucionirala liječenje raka. Umjesto izravnog ciljanja tumora, imunoterapija usmjerava imunološki sustav pacijenata da učinkovitije napada tumore. Ovo je posebno učinkovito za neke vrste raka koje je teško liječiti. Međutim, manje od polovice svih pacijenata s rakom reagira na trenutačne imunoterapije, što stvara hitnu potrebu za identificiranjem biomarkera koji mogu predvidjeti koji će pacijenti najvjerojatnije imati koristi od liječenja.
Nedavno su znanstvenici primijetili da je veća vjerojatnost da će pacijenti čiji tumori imaju mutaciju gena ARID1A pozitivno odgovoriti na blokadu imunološke kontrolne točke, vrstu imunoterapije koja djeluje. Održavanju aktiviranim imunološke stanice koje se bore protiv raka.
Budući da je mutacija gena ARID1A prisutna u mnogim vrstama raka, uključujući rak endometrija, jajnika, debelog crijeva, želuca, jetre i gušterače, istraživači Instituta Salk zapitali su se kako bi to moglo pridonijeti osjetljivosti liječenja i kako bi kliničari mogli upotrijebiti te informacije za personalizaciju raka tretman za svakog pacijenta.
Njihova nova studija, objavljena u časopisu Cell pokazuje da mutacija ARID1A čini tumore osjetljivima na imunoterapiju regrutiranjem imunoloških stanica koje se bore protiv raka na tumor putem imunološkog odgovora. Slično antivirusnom.
Istraživači sugeriraju da bi se ova mutacija i antivirusni imunološki odgovor mogli koristiti kao biomarker za bolji odabir pacijenata za specifične imunoterapije, kao što je blokada imunološke kontrolne točke. Ovi rezultati također potiču razvoj lijekova koji ciljaju ARID1A i njegove povezane proteine kako bi druge tumore učinili osjetljivijima na imunoterapiju.
"Ovo bi stvarno moglo promijeniti ishod liječenja raka za pacijente", kaže izvanredna profesorica Diana Hargreaves, viša autorica studije. "Pacijenti s mutacijom ARID1A već imaju imunološki odgovor, tako da sve što trebamo učiniti je pojačati taj odgovor blokadom imunoloških kontrolnih točaka kako bismo im pomogli uništiti svoje tumore iznutra."
Iako je poznato da ljudi s mutacijama ARID1A dobro reagiraju na blokadu imunološke kontrolne točke, točan odnos između to dvoje ostao je nejasan. Kako bi razjasnili mehanizam ovog procesa, znanstvenici s Instituta Salk koristili su mišje modele melanoma i kolorektalnog raka s ARID1A mutacijom i funkcionalnim ARID1A.
Izvor: Cell (2024). DOI: 10.1016/j.cell.2024.04.025
Tim je uočio snažan imunološki odgovor u svim modelima s mutacijom ARID1A, ali ne i u onima u kojima je ARID1A bio funkcionalan, podupirući ideju da mutacija ARID1A doista pokreće ovaj odgovor. Ali kako to funkcionira na molekularnoj razini?
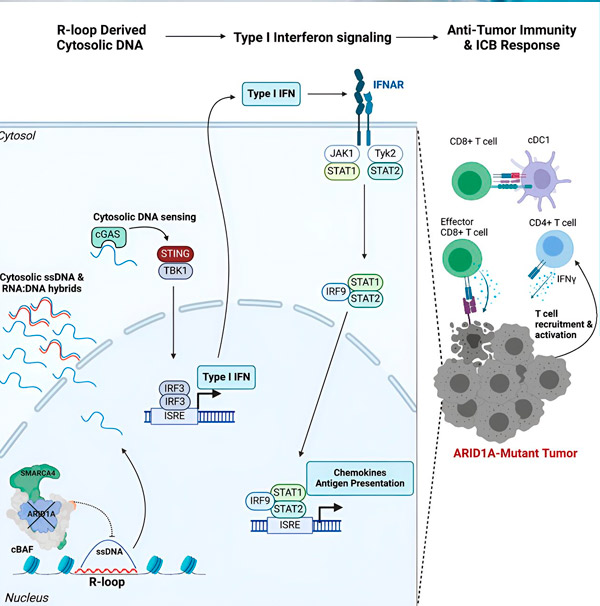
"Otkrili smo da ARID1A igra važnu ulogu u jezgri održavajući ispravnu organizaciju DNK", kaže Matthew Maxwell, prvi autor studije i postdiplomac u laboratoriju Hargreaves. "Bez funkcionalnog ARID1A, slobodna DNA može se izrezati i otpustiti u citosol, što aktivira željeni antivirusni imunološki odgovor, koji se može pojačati blokadom imunološke kontrolne točke."
Gen ARID1A kodira protein koji pomaže regulirati oblik naše DNK i održavati stabilnost genoma. Kada ARID1A mutira, u stanicama raka pokreće se lanac događaja sličan stroju Rubea Goldberga.
U početku, odsutnost funkcionalnog ARID1A rezultira otpuštanjem DNK u citosol. Citosolna DNK zatim aktivira antivirusni alarmni sustav, cGAS-STING put, jer su naše stanice prilagođene da označe bilo koju DNK u citosolu kao stranu kako bi se zaštitile od virusnih infekcija. U konačnici, cGAS-STING put regrutira imunološki sustav da regrutira T stanice u tumor i aktivira ih u specijalizirane T stanice ubojice raka.
U svakom koraku, ovisno o prethodnom, ovaj lanac događaja—mutacija ARID1A, bijeg DNK, upozorenje za cGAS-STING, regrutiranje T-stanica—rezultira povećanjem broja T-stanica koje se bore protiv raka u tumoru. Blokada imunološke kontrolne točke tada se može koristiti kako bi se osiguralo da te T-stanice ostanu aktivirane, povećavajući njihovu sposobnost da pobijede rak.
"Naša otkrića pružaju novi molekularni mehanizam pomoću kojeg mutacija ARID1A može pridonijeti antitumorskom imunološkom odgovoru", kaže Hargreaves. "Najuzbudljivija stvar kod ovih rezultata je njihov translacijski potencijal. Možemo koristiti ARID1A mutacije za odabir pacijenata za blokadu imunološke kontrolne točke, a sada vidimo mehanizam pomoću kojeg bi se lijekovi koji inhibiraju ARID1A ili njegov proteinski kompleks mogli koristiti za daljnje poboljšanje imunoterapije kod drugih pacijenata."
Opisivanjem mehanizma po kojem je blokada imunološke kontrolne točke učinkovitija za karcinome s mutacijom ARID1A, istraživači daju obrazloženje kliničarima da daju prednost ovoj imunoterapiji za pacijente s mutacijom ARID1A. Ovi rezultati predstavljaju važan korak u personaliziranju liječenja raka i nadahnjuju razvoj novih terapija usmjerenih na inhibiciju ARID1A i njegovog proteinskog kompleksa.
U budućnosti, tim Instituta Salk nada se da će njihova otkrića poboljšati rezultate za pacijente s različitim vrstama raka povezanim s mutacijama ARID1A i namjeravaju istražiti ovaj klinički prijevod u suradnji sa Sveučilištem Kalifornije u San Diegu. p>
