Medicinski stručnjak članka
Nove publikacije
Eksperimentalni modeli osteoartritisa
Posljednji pregledao: 07.07.2025

Svi iLive sadržaji medicinski se pregledavaju ili provjeravaju kako bi se osigurala što je moguće točnija činjenica.
Imamo stroge smjernice za pronalaženje izvora i samo povezujemo s uglednim medijskim stranicama, akademskim istraživačkim institucijama i, kad god je to moguće, medicinski pregledanim studijama. Imajte na umu da su brojevi u zagradama ([1], [2], itd.) Poveznice koje se mogu kliknuti na ove studije.
Ako smatrate da je bilo koji od naših sadržaja netočan, zastario ili na neki drugi način upitan, odaberite ga i pritisnite Ctrl + Enter.
Hrskavica je visoko specijalizirano tkivo koje sadrži samo jednu vrstu stanica (hondrocite) i karakterizira ga odsutnost krvnih i limfnih žila. Hrskavica se uglavnom hrani apsorpcijom iz sinovijalne tekućine. Metabolizam hondrocita reguliran je nizom topljivih čimbenika koje lokalno proizvode hondrociti i okolna tkiva. Funkcija hondrocita također ovisi o sastavu izvanstanične okoline (napon kisika, koncentracija iona, pH itd.), sastavu izvanceličnog materijala (ECM), interakciji stanica i matrice te fizičkim signalima. Glavni cilj eksperimentalnog modeliranja je stvaranje kultura u izvanstaničnoj okolini bez promjene fenotipa zrelih stanica. Drugi cilj je stvaranje kultura za proučavanje preranog, odgođenog, kratkoročnog ili produljenog odgovora hondrocita na kemijske i/ili fizičke signale. Studije in vitro također pružaju priliku za proučavanje ponašanja hondrocita kod osteoartroze. Treći cilj je razvoj sustava kokulture koji omogućuju proučavanje interakcija različitih tkiva u zglobu. Četvrti zadatak je priprema hrskavičnih implantata za naknadnu transplantaciju. I konačno, peti zadatak je proučavanje faktora rasta, citokina ili terapijskih sredstava koja su sposobna stimulirati reparaciju i/ili inhibirati resorpciju hrskavice.
Tijekom proteklih desetljeća stvoreni su različiti modeli staničnih kultura zglobne hrskavice, uključujući monoslojne kulture, suspendirane kulture, hondronske kulture, eksplantate, kokulture i besmrtne stanične kulture. Svaka kultura ima svoje prednosti i nedostatke, te je svaka prikladna za proučavanje jednog specifičnog aspekta metabolizma hondrocita. Stoga su eksplantati hrskavice izvrstan model za proučavanje prometa elemenata matrice, što zahtijeva prave receptore na površini stanica i normalne interakcije stanica-matriks i matriks-stanica. Istovremeno, preporučuje se proučavanje matriksnih naslaga ili mehanizama koji reguliraju metabolizam hondrocita na kulturi izoliranih stanica. Monoslojna kultura niske gustoće neophodna je za proučavanje procesa diferencijacije stanica. Kulture suspendirane u prirodnoj ili sintetičkoj matrici model su za analizu adaptivnog odgovora hondrocita na mehanički stres.
Kulture hondrocita
Pri odabiru hrskavičnog tkiva za in vitro studije treba uzeti u obzir nekoliko važnih točaka. Sastav matrice i metabolička aktivnost hondrocita variraju među zglobovima, a potonje također ovisi o dubini lokacije hondrocita u tkivu. Ovi podaci dobiveni su u nekoliko eksperimenata u kojima su proučavane izolirane subpopulacije hondrocita iz hrskavičnih zona različitih dubina. Pronađen je niz morfoloških i biokemijskih razlika između kultiviranih hondrocita smještenih u površinskim i dubokim slojevima zglobne hrskavice. Površinske stanice sintetiziraju rijetku, proteoglikanima siromašnu fibrilnu matricu, dok dublje stanice proizvode matricu bogatu fibrilima i proteoglikanima. Štoviše, površinske stanice proizvode relativno više malih neagregiranih proteoglikana i hijaluronske kiseline te relativno manje agrekana i keratan sulfata od dubljih hondrocita. Druga važna karakteristika metabolizma hondrocita izoliranih iz hrskavičnih zona različitih dubina je odgovor na egzogeni podražaj. Prema M. Aydelotteu i suradnicima, goveđi hondrociti iz površinske zone hrskavice bili su osjetljiviji na IL-1 od stanica iz duboke zone.
Ponašanje stanica također ovisi o lokaciji tkiva. Hondrociti iz hrskavice rebara i uha iste životinje različito reagiraju na faktore rasta kao što su faktor rasta fibroblasta (FGF) i TGF-beta. FGF je povećao ugradnju timidina, prolina i leucina u kultivirano rebro, ali ne i hondrocite uha. TGF-beta je povećao ugradnju timidina u hondrocite hrskavice rebara i uha, ali nije imao utjecaja na ugradnju timidina i prolina u hondrocite uha. Stanice hrskavice iz područja visokog stresa razlikuju se od onih iz područja niskog stresa na hrskavicu. Dakle, hondrociti zrele hrskavice koljenskog zgloba ovaca iz središnjeg područja zglobne površine tibije koje nije prekriveno meniskusom, a koje in vivo podnosi najveće opterećenje, sintetiziraju manje agrekana, ali više dekorina od stanica iz zona prekrivenih meniskusom. Autori također naglašavaju važnost korištenja hrskavice iz identičnih zglobnih zona pri proučavanju sintetske funkcije zglobova.
Metabolizam hondrocita i njihov odgovor na regulatorne čimbenike također značajno ovise o dobi darivatelja, njegovom razvoju kostura i stanju zglobova iz kojih se stanice uzimaju. Kod ljudskih hondrocita opaža se značajno smanjenje proliferativnog odgovora s godinama. Najveće smanjenje opaža se kod darivatelja u dobi od 40-50 godina i starijih od 60 godina. Štoviše, težina proliferativnog odgovora na faktore rasta (npr. FGF i TGF-beta) smanjuje se sa starenjem. Osim kvantitativnih promjena u proliferaciji hondrocita, postoje i kvalitativne promjene. Stanice mladih darivatelja (10-20 godina) bolje reagiraju na faktor rasta izveden iz trombocita (PDGF) nego na TGF-beta, dok se suprotno opaža kod stanica odraslih darivatelja. Nekoliko mehanizama koristi se za objašnjenje promjena sintetske funkcije hondrocita i njihovog odgovora na faktore rasta ovisnih o dobi. To uključuje smanjenje broja i afiniteta receptora površinskih stanica, promjene u sintezi i bioaktivnosti faktora rasta i citokina te modifikaciju postreceptorskih signala.
Patološko stanje zglobova također mijenja morfologiju i metaboličku aktivnost hondrocita. Tako su J. Kouri i sur. (1996.) identificirali tri subpopulacije hondrocita u hrskavici kod osteoartroze. Hondrociti iz površinskog i gornjeg dijela srednje hrskavice formiraju nakupine i sintetiziraju veću količinu proteoglikana i kolagena. TGF-beta i inzulinu sličan faktor rasta (IGF) sposobni su stimulirati sintezu proteoglikana hondrocitima i djelomično neutralizirati učinke IL-1 i TNF-a. Eksplantati hrskavice zahvaćene osteoartrozom i hondrociti izolirani iz hrskavice pacijenta s osteoartrozom osjetljiviji su na stimulaciju TGF-beta od hondrocita zdrave hrskavice. Ove razlike najvjerojatnije su povezane s fenotipskim promjenama hondrocita u gornjim slojevima zglobne hrskavice.
Izolacija pojedinačnih hondrocita postiže se sekvencijalnim tretmanom izvanceličnog matičnog tkiva (ECM) proteolitičkim enzimima. Nakon oslobađanja iz ECM-a, izolirane stanice idealne su za proučavanje de novo sinteze komponenti matrice. Neki autori koriste samo klostridijalnu kolagenazu, dok drugi prethodno inkubiraju hrskavicu s tripsinom, pronazom, DNazom i/ili hijaluronidazom. Broj izoliranih stanica ovisi o korištenim enzimima. Dakle, kada se tretira samo kolagenazom, iz 1 g tkiva može se dobiti 1,4-10⁶ hondrocita, dok se korištenjem pronaze, hijaluronidaze i kolagenaze -4,3-10⁶. Kada se tretira kolagenazom, agrekan, proteini, IL-6 i IL-8 ostaju u staničnoj kulturi u znatno većim količinama nego kod sekvencijalnog tretmana različitim enzimima. Postoji nekoliko objašnjenja za ove razlike između dvije stanične kulture:
- Stanični receptori su oštećeni ili inhibirani enzimima, TGF-beta inhibira sintezu DNA i proteoglikana u svježe izoliranim hondrocitima (1. dan), dok sintezu DNA i proteoglikana u hondrocitima uzgajanim u monosloju (7 dana) stimulira TGF-beta. Međutim, prije početka eksperimenta potrebno je odgovarajuće razdoblje za ponovnu ekspresiju ovih membranskih komponenti.
- Egzogene proteaze mogu poremetiti interakciju stanica i matrice posredovanu integrinom. Obitelj integrina potiče vezanje hondrocita na molekule izvanceličnog matriksa (Shakibaei M. et al., 1997.). Ovaj poremećaj može utjecati na ekspresiju gena matrice.
- Ostaci komponenti matrice mogu regulirati sintetsku funkciju hondrocita. Integrini su sposobni prepoznati produkte razgradnje izvanceličnog matičnog tkiva (ECM), te stoga igraju važnu ulogu u popravku tkiva nakon djelovanja proteolitičkih enzima. T. Larsson i sur. (1989.) izvijestili su da dodavanje intaktnih ili fragmentiranih proteoglikana u staničnu kulturu stimulira sintezu proteina i proteoglikana. Međutim, visoka razina hijaluronske kiseline uzrokuje značajno smanjenje uključivanja sulfata u sintezu proteoglikana hondrocitima pilećeg embrija, zrelim hondrocitima svinje i stanicama hondrosarkoma štakora. Štoviše, hijaluronska kiselina je inhibitor oslobađanja proteoglikana iz stanica čak i u prisutnosti IL-1b, TNF-a, FGF-a, što ukazuje na suzbijanje prve biološke aktivnosti faktora rasta i citokina. Točan mehanizam djelovanja hijaluronske kiseline ostaje nejasan; Poznato je da hondrociti sadrže receptor za hijaluronsku kiselinu povezan s aktinskim filamentima citosola. Vezanje hijaluronske kiseline na njezin receptor stimulira fosforilaciju proteina. Dakle, ovi podaci pokazuju modulaciju metaboličke funkcije hondrocita fragmentiranim ili nativnim molekulama proteina matrice putem aktivacije receptora stanične membrane.
- Brza stimulacija sinteze proteina matrice od strane hondrocita enzimima može biti posljedica promjena u obliku hondrocita i/ili reorganizacije citoskeleta.
- Neki citokini (npr. IL-8) i faktori rasta (npr. IGF-1, TGF-β) sekvestriraju u izvanceličnom matičnjaku (ECM). Najpoznatiji primjer je vezanje TGF-β dekorinom, što rezultira smanjenom sposobnošću prvog da inducira rast stanica u stanicama jajnika kineskog hrčka. Nalaz da se sadržaj dekorina u hrskavici povećava s godinama sugerira smanjenje bioraspoloživosti TGF-β sa starenjem. Faktori rasta i citokini mogu se osloboditi iz ostataka matrice tijekom kulture i potom modulirati funkciju hondrocita.
Monoslojna kultura hondrocita
Diferencirani fenotip hondrocita prvenstveno karakterizira sinteza kolagena tipa II i tkivno specifičnih proteoglikana, kao i niska razina mitotičke aktivnosti. Postoje dokazi da duljim uzgojem stanica u monosloju, kao i nakon nekoliko ponovljenih pasaža stanica, hondrociti gube svoje sferne obrise i dobivaju izduženi oblik sličan fibroblastima. S takvom fibroblastičnom metaplazijom modificira se i sintetska funkcija stanica, karakterizirana progresivnim smanjenjem sinteze kolagena tipa II, IX i XI te povećanjem sinteze kolagena tipa I, III i Y. Mali neagregirani proteoglikani sintetiziraju se zbog funkcionalnog agrekana. Sinteza katepsina B i L izuzetno je niska u diferenciranim stanicama, ali se povećava u procesu gubitka diferencijacije. Kolagenaza-1 se eksprimira u diferenciranim hondrocitima; duljim uzgojem njezina ekspresija se smanjuje, dok se povećava proizvodnja tkivnih inhibitora metaloproteinaza (TIMP).
Diferencirani hondrociti ponovno eksprimiraju kolagen diferenciranog fenotipa kada se prenesu iz monosloja u suspendiranu kulturu. Proces diferencijacije vjerojatno je povezan s oblikom stanica. Ovo svojstvo redovito koriste istraživači koji proučavaju defektne transplantate s autolognim hondrocitima. Mali broj stanica dobivenih iz biopsijskog materijala može se proširiti u monoslojnoj kulturi, a zatim ponovno uvesti u trodimenzionalnu matricu prije transplantacije. Ponovnu ekspresiju specifičnog fenotipa dediferenciranim hondrocitima prenesenim u agaroznu kulturu mogu stimulirati TGF-β, osein-hidroksiapatitni kompleks i askorbinska kiselina.
Kao odgovor na faktore rasta i citokine, hondrociti se modificiraju tijekom procesa diferencijacije. Stanični odgovor na citokine i faktore rasta razlikuje se između nediferenciranih i diferenciranih hondrocita. IL-1 stimulira proliferaciju fibroblasta, dok IL-1 inhibira rast nediferenciranih hondrocita. Sintezu DNA stimulira IGF-1 u izduženim, ali ne i spljoštenim hondrocitima. U diferenciranim hondrocitima, stimulacijski učinci IL-1beta i TNF-a na proizvodnju prokolagenaze izraženiji su nego u nediferenciranim hondrocitima.
Uzgoj hondrocita
Uzgoj hondrocita u suspenziji u tekućem mediju ili u prirodnoj ili sintetičkoj trodimenzionalnoj matrici stabilizira fenotip hondrocita. Stanice zadržavaju svoj sferni oblik i sintetiziraju tkivno specifične proteine. Suspendirana kultura hondrocita obično se preporučuje za proučavanje stvaranja novog pericelularnog matriksa. Kulture hondrocita u sintetičkim ili prirodnim apsorbirajućim polimerima koriste se za implantaciju stanica u defekte hrskavice kako bi se potaknula regeneracija zglobnog hrskavičnog tkiva. Sintetički ili prirodni medij za implantirane stanice mora ispunjavati niz zahtjeva:
- implantati moraju imati poroznu strukturu za prianjanje i rast stanica,
- ni sam polimer ni njegovi produkti razgradnje ne bi smjeli uzrokovati upalu ili toksične reakcije kada se implantiraju in vivo,
- Nosač transplantata mora imati sposobnost vezanja za susjednu hrskavicu ili subhondralnu kost,
- prirodna ili sintetička matrica mora imati sposobnost apsorpcije, njezina razgradnja mora biti uravnotežena regeneracijom tkiva,
- Kako bi se olakšao popravak hrskavice, kemijska struktura i arhitektura pora matrice moraju olakšati održavanje staničnog fenotipa i sintezu tkivno specifičnih proteina pomoću hondrocita smještenih u njoj,
- Tijekom implantacije in vivo potrebno je proučiti mehanička svojstva sintetske ili prirodne matrice.
 [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Suspenzija hondrocita u tekućoj fazi
Pričvršćivanje stanica na plastične posude u kojima se uzgajaju hondrociti može se spriječiti premazivanjem njihovih stijenki otopinom metilceluloze, agaroze, hidrogela (poli-2-hidroksietil metakrilat) ili smjesom kolagena i agaroze. U tim uvjetima, hondrociti formiraju nakupine i sintetiziraju uglavnom agrekane i tkivno specifične kolagene (II, IX, XI tipovi). Obično se nalaze dvije vrste stanica. Stanice smještene u središtu zadržavaju sferni oblik i okružene su dobro razvijenim izvanceličnim matičnim tkivom (ECM), što potvrđuju histokemijske i ultrastrukturne studije. Na periferiji, hondrociti imaju diskoidne obrise i okruženi su rijetkim ECM-om; malo se zna o funkcionalnim karakteristikama takvih stanica.
Moguće je uzgajati hondrocite na mikronosačima koji se održavaju u suspenziji; kao mikronosači koriste se dekstran kuglice (cytodex), dekstran kuglice obložene kolagenom (cytodex III) i neporozne mikrosfere kolagena tipa I (cellagen). U tim uvjetima uzgoja, hondrociti se pričvršćuju na površinu mikronosača, zadržavaju svoj sferni oblik i proizvode materijal sličan matrici. Štoviše, upotreba cellagena potiče proliferaciju hondrocita i ponovnu ekspresiju normalnog fenotipa. Stoga se uzgoj hondrocita na cellagen mikrosferama može koristiti za vraćanje staničnog fenotipa prije transplantacije.
Druga metoda uzgoja suspenzije hondrocita u tekućem mediju je njihov uzgoj u obliku gustih kuglica koje se sastoje od stanica (0,5-1 * 10 b ), dobivenih centrifugiranjem. Takvi hondrociti sposobni su proizvesti matricu koja sadrži veliku količinu proteoglikana, kolagena tipa II, ali ne i kolagena tipa I, što je potvrđeno histološkim, imunohistokemijskim i kvantitativnim metodama.
Suspenzija hondrocita u prirodnom ECM-u
Hondrociti se mogu uzgajati u suspenziji u trodimenzionalnoj matrici (meki agar, agaroza, kolageni gel ili spužva, hijaluronska kiselina, fibrinsko ljepilo, alginatne kuglice).
Hondrociti uzgajani u agarozi zadržavaju svoj normalni fenotip i sintetiziraju kolagen tipa II i tkivno specifične agregate agrekana. Kada se uzgajaju u agarozi, proteoglikani koje sintetizira stanica oslobađaju se u medij tijekom 50 dana. Za usporedbu, u monoslojnoj kulturi, stanična faza je prepunjena glikozaminoglikanima već u prvih 5-6 dana uzgoja; kada se uzgajaju u mediju, nakon povećane sinteze i oslobađanja glikozaminoglikana u prvih 8-10 dana, dolazi do njihovog vremenski ovisnog smanjenja. Ipak, ponašanje hondrocita kada se uzgajaju u agarozi razlikuje se od onog in vivo. U agarozi, veliki broj sintetiziranih agregata agrekana sadrži manje molekule i manje molekula nego in vivo. TGF-β stimulira sintezu proteoglikana u eksplantu, ali smanjuje sintezu agrekana u agarozi.
Alginat je linearni polisaharid dobiven iz smeđih morskih algi. U prisutnosti dvovalentnih kationa, poput Ca2 + iona, ovaj polimer postaje gel. Svaki hondrocit zarobljen u alginatu okružen je matricom negativno nabijenih polisaharida, čije su pore usporedive s onima u hijalinskoj hrskavici. Matrica koju tvore hondrociti u alginatnim kuglicama sastoji se od dva odjeljka - tankog sloja matrice povezane sa stanicama koji odgovara pericelularnoj i teritorijalnoj matrici zglobne hrskavice i udaljenije matrice ekvivalentne interteritorijalnoj u nativnom tkivu. 30. dana kulture, relativni i apsolutni volumen koji zauzimaju stanice i svaki od dva odjeljka u alginatnoj kuglici gotovo su potpuno identični onima u nativnoj hrskavici. Gotovo 30 dana hondrociti zadržavaju svoj sferni oblik i proizvode agrekan, čija su hidrodinamička svojstva slična svojstvima molekula agrekana u matrici zglobne hrskavice, kao i molekule kolagena tipova II, IX i XI. Istovremeno, kao i kod drugih suspenzijskih kultura, na površini alginatnih kuglica prisutne su spljoštene stanice koje proizvode malu količinu molekula kolagena tipa I, koje se izravno oslobađaju u medij i ne ugrađuju se u ECM. U alginatnim kuglicama uočena je umjerena proliferacija hondrocita. Nakon 8 mjeseci uzgoja u alginatnom gelu, zreli hondrociti ne gube metaboličku aktivnost i nastavljaju sintetizirati tkivno specifični kolagen tipa II i agrekan.
H. Tanaka i sur. (1984.) istraživali su difuzijska svojstva različitih prirodnih molekula u alginatu i otkrili da molekule veće od 70 kDa ne difundiraju kroz alginat. Stoga je stanična kultura u alginatu prikladna za proučavanje regulacije biosinteze matrice i organizacije izvanceličnog matičnog tkiva (ECM). Dostupnost stanica uzgajanih u alginatu omogućuje proučavanje djelovanja peptidnih regulatornih faktora i farmakoloških sredstava na transkripcijskoj, posttranskripcijskoj i translacijskoj razini.
Hondrociti se također uzgajaju u matrici kolagenih vlakana tipova I i II. S. Nehrer i sur. (1997.) usporedili su funkcioniranje psećih hondrocita u poroznim matricama kolagen-proteoglikanskog polimera koje sadrže kolagene različitih tipova. Pronašli su važne razlike u morfologiji biosintetske funkcije hondrocita uzgajanih u kolagenim matricama koje sadrže kolagen tipove I i II. Stanice u matrici kolagena tipa II zadržale su svoj sferni oblik, dok su u kolagenu tipa I imale morfologiju sličnu fibroblastima. Štoviše, u matrici kolagena tipa II, hondrociti su proizveli veću količinu glikozaminoglikana. J. van Susante i sur. (1995.) usporedili su svojstva hondrocita uzgajanih u alginatnom i kolagenom (tip I) gelu. Autori su otkrili značajno povećanje broja stanica u kolagenom gelu, ali od 6. dana uzgoja stanice su izgubile svoj karakteristični fenotip, pretvarajući se u stanice slične fibroblastima. U alginatnom gelu uočeno je smanjenje broja stanica, ali su hondrociti zadržali svoj normalni fenotip. U kolagenom gelu broj proteoglikana po stanici bio je značajno veći nego u alginatu, ali u gelu je uočeno smanjenje sinteze elemenata matrice, počevši od 6. dana uzgoja, dok je u alginatu sinteza nastavila rasti.
Čvrsta trodimenzionalna fibrinska matrica je prirodna tvar koja podržava hondrocite suspendirane u njoj u diferenciranom fenotipu. Trodimenzionalna fibrinska matrica također se može koristiti kao nosač u transplantaciji hondrocita. Prednosti fibrina su odsutnost citotoksičnosti, sposobnost popunjavanja prostora i adhezivni kapacitet. Histološke i biokemijske studije, autoradiografija i elektronska mikroskopija pokazale su da hondrociti u fibrinskom gelu zadržavaju svoju morfologiju, proliferiraju i proizvode matricu čak i nakon 2 tjedna kultivacije. Međutim, G. Homminga i sur. (1993.) izvijestili su da dezintegracija fibrina počinje nakon 3 dana kultivacije, a dediferencijacija hondrocita napreduje.
Suspenzija hondrocita u umjetnom (sintetskom) ECM-u
Hrskavični implantati za rekonstruktivnu ili ortopedsku kirurgiju mogu se dobiti uzgojem izoliranih hondrocita in vitro u sintetskoj biokompatibilnoj matrici.
Hondrociti uzgajani u poliglikolnoj kiselini proliferiraju i održavaju normalnu morfologiju i fenotip tijekom 8 tjedana. Kompleks hondrocita i poliglikolne kiseline sastoji se od stanica, glikozaminoglikana, kolagena i ima vanjsku kolagenu kapsulu. Međutim, takvi implantati sadrže dvije vrste molekula kolagena - I i II. Implantati iz hondrocita dediferenciranih nizom pasaža imaju veću količinu glikozaminoglikana i kolagena od implantata iz primarno nediferenciranih hondrocita.
L. Freed i sur. (1993b) usporedili su ponašanje kultura ljudskih i goveđih hondrocita u vlaknastoj poliglikolnoj kiselini (FPGA) i poroznoj polimliječnoj kiselini (PPLA). Nakon 6-8 tjedana uzgoja goveđih hondrocita u FPGA ili PPLA, autori su primijetili proliferaciju stanica i regeneraciju hrskavičnog matriksa. U FPGA, hondrociti su imali sferni oblik i nalazili su se u lakunama okruženim hrskavičnim matricom. Nakon 8 tjedana uzgoja in vitro, regenerirano tkivo sadržavalo je do 50% suhe tvari (4% stanične mase, 15% glikozaminoglikana i 31% kolagena). U PPLA, stanice su imale vretenasti oblik i malu količinu glikozaminoglikana i kolagena. U FPGA, rast stanica bio je 2 puta intenzivniji nego u PPLA. In vivo, hondrociti uzgojeni u VPGK i PPLC proizveli su tkivo histološki slično hrskavici unutar 1-6 mjeseci. Implantati su sadržavali glikozaminoglikane, kolagene tipa I i II.
Honedrociti goveđeg fetusa uzgajani su u poroznom hidrofobnom i hidrofilnom polietilenu visoke gustoće. Nakon 7 dana inkubacije u oba supstrata, stanice su zadržale sferni oblik i sadržavale su uglavnom kolagen tipa II. Nakon 21 dana uzgoja, utvrđeno je da hidrofilna matrica sadrži više kolagena tipa II nego hidrofobna matrica.
Hrskavično tkivo može se dobiti i uzgojem u monosloju na Millicell-CM filterima. Prethodno premazivanje filtera kolagenom potrebno je za vezanje hondroitina. Histološki pregled kulture pokazuje nakupljanje hondrocita u izvanceličnom materijalu (ECM) koji sadrže proteoglikane i kolagen tipa II. Kolagen tipa I nije otkriven u takvoj kulturi. Hondrociti u dobivenom hrskavičnom tkivu su sfernog oblika, ali na površini tkiva su donekle spljošteni. Debljina novonastalog tkiva povećavala se s vremenom i ovisila je o početnoj gustoći staničnog monosloja. U optimalnim uvjetima uzgoja, debljina hrskavičnog tkiva dosegla je 110 μm, organizacija njegovih stanica i kolagena u površinske i duboke slojeve slična je onoj u zglobnoj hrskavici. ECM sadrži približno 3 puta više kolagena i proteoglikana. Nakon 2 tjedna uzgoja uočeno je nakupljanje matrice, što je omogućilo izdvajanje tkiva iz filtera i korištenje za transplantaciju.
Sims i sur. (1996.) proučavali su uzgoj hondrocita u polietilen oksidnom gelu, enkapsuliranoj polimernoj matrici koja omogućuje prijenos velikog broja stanica injekcijom. Šest tjedana nakon injekcije u potkožno tkivo atimičnih miševa, formirana je nova hrskavica, koja je morfološki karakterizirana bijelom opalescencijom sličnom hijalinskoj hrskavici. Histološki i biokemijski podaci ukazivali su na prisutnost aktivno proliferirajućih hondrocita koji proizvode ECM.
Eksplantacija
Eksplantacija hrskavičnog tkiva koristi se za proučavanje procesa ana- i katabolizma u njemu, održavanja homeostaze, resorpcije i popravka. Hondrociti u eksplantima hrskavice održavaju normalan fenotip i sastav izvanceličnog matičnog tkiva (ECM) sličan onima u zglobnoj hrskavici in vivo. Nakon 5 dana uzgoja u prisutnosti seruma postiže se konstantna razina sinteze i prirodnih procesa razgradnje. Resorpcija tkiva može se ubrzati u glavnoj kulturi i u kulturi dodatkom seruma korištenjem niza sredstava, kao što su IL-IB, TNF-a, bakterijski lipopolisaharid, derivati retinoične kiseline ili aktivni kisikovi radikali. Za proučavanje popravka hrskavice, njezino oštećenje induciraju topljivi upalni medijatori (H 2 O 2, IL-1, TNF-a) ili fizička ruptura matrice.
Metoda organotipske kulture je model za in vitro studije učinaka izoliranih vanjskih čimbenika na hondrocite i okolni matriks. In vivo, hondrociti su rijetko smješteni u izvanceličnom matičnjaku (ECM) i ne dodiruju se međusobno. Kultura eksplantata zglobne hrskavice čuva ovu strukturnu organizaciju, kao i specifične interakcije između hondrocita i okolnog izvanstaničnog okruženja. Ovaj se model također koristi za proučavanje učinaka mehaničkog stresa, farmakoloških sredstava, faktora rasta, citokina i hormona na metabolizam hrskavice.
Još jedna prednost eksplantacije hrskavičnog tkiva je odsutnost oštećenja hondrocita pod djelovanjem proteolitičkih enzima ili mehaničkih čimbenika, što je neizbježno pri izolaciji stanica. Receptori i drugi membranski proteini i glikoproteini zaštićeni su od štetnih čimbenika.
 [ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]
[ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]
Hondronska kultura
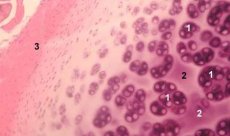
Hondron je strukturna, funkcionalna i metabolička jedinica zglobne hrskavice koja se sastoji od hondrocita, njegove pericelularne matrice i kompaktne filamentozne kapsule te je odgovorna za homeostazu matrice. Hondroni se mehanički izdvajaju iz hrskavice i skupljaju pomoću nekoliko uzastopnih homogenizacija malom brzinom. Hondroni izolirani iz zona različitih dubina hrskavice mogu se podijeliti u četiri kategorije: pojedinačni hondroni, parni hondroni, višestruki (tri ili više) linearno raspoređeni hondroni (kolumne hondrona) i nakupine hondrona.
Pojedinačni hondroni obično se nalaze u srednjim slojevima intaktne hrskavice, upareni hondroni nalaze se na granici srednjeg i dubokog sloja, linearno raspoređeni višestruki hondroni tipični su za duboke slojeve intaktne hrskavice. Konačno, nakupine hondrona sastoje se od nasumično organiziranih skupina pojedinačnih i uparenih hondrona, koji zadržavaju agregirano stanje nakon homogenizacije. Kupine hondrona su veliki fragmenti hrskavice, obično sadrže nekoliko hondrona i radijalno raspoređene kolagene fibrile, tj. tipična organizacija karakteristična za duboke slojeve matrice. Hondroni su imobilizirani u prozirnoj agarozi, što omogućuje proučavanje njihove strukture, molekularnog sastava i metaboličke aktivnosti. Sustav hondrona-agaroze smatra se mikromodelom hrskavice, koji se razlikuje od tradicionalnog sustava hondrocita-agaroze po tome što je očuvano prirodno mikrookruženje i nema potrebe za njegovom sintezom i sastavljanjem. Kultura hondrona je model za proučavanje interakcija stanica i matriksa u zglobnoj hrskavici u normalnim i patološkim uvjetima.
 [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
[ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
Kultura besmrtnih hondrocita
Rekombinantna DNA ili virusi koji sadrže onkogen sposobni učiniti stanicu "besmrtnom" koriste se za stvaranje trajnih staničnih linija. Besmrtni hondrociti imaju sposobnost beskonačne proliferacije uz održavanje stabilnog fenotipa. F. Mallein-Gerin i sur. (1995.) pokazali su da onkogen SV40T inducira proliferaciju mišjih hondrocita, koji nastavljaju stabilno eksprimirati kolagen tipova II, IX i XI, kao i artikularni agrekan i vezni protein. Međutim, takva stanična linija stječe sposobnost sinteze kolagena tipa I kada se uzgaja u monoslojnoj kulturi ili u agaroznom gelu.
W. Horton i sur. (1988.) opisali su liniju besmrtnih stanica s niskom razinom ekspresije mRNA kolagena tipa II. Ove stanice dobivene su njihovom transformacijom mišjim retrovirusom koji sadrži I-myc- i y-ra-onkogene. Ovaj tip stanica predstavlja jedinstveni model za proučavanje interakcija artikularne matrice u odsutnosti kolagena tipa II, kao i regulaciju sinteze kolagena tipa II.
Kultura hondroprita s mutiranim ili izbrisanim genima prikladan je model za proučavanje njihove fiziološke funkcije. Ovaj model je posebno prikladan za proučavanje uloge specifičnih molekula u organizaciji hrskavičnog matriksa ili za istraživanje učinaka različitih regulatornih čimbenika na metabolizam hrskavice. Hondrociti s izbrisanim genom za kolagen tipa IX sintetiziraju kolagene fibrile koje su šire od normalnih, što ukazuje na to da kolagen tipa IX regulira promjer fibrila. Kao što je navedeno u 1. poglavlju, mutacija u genu COLAI koji kodira kolagen tipa II nedavno je otkrivena u obiteljima s primarnim generaliziranim osteoartritisom. Kako bi proučili učinak mutiranog kolagena tipa II na zglobni matriks, R. Dharmrvaram i sur. (1997.) transficirali su (inficirali stranom nukleinskom kiselinom) defektni COL 2 AI (arginin na položaju 519 zamijenjen je cisteinom) u ljudske fetalne hondrocite in vitro.
Sustav kokulture. U zglobu hrskavica međusobno djeluje s drugim vrstama stanica koje se nalaze u sinovijalnoj membrani, sinovijalnoj tekućini, ligamentima i subhondralnoj kosti. Na metabolizam hondrocita mogu utjecati različiti topljivi čimbenici koje sintetiziraju navedene stanice. Dakle, kod artritisa, zglobnu hrskavicu uništavaju proteolitički enzimi i slobodni radikali koje proizvode sinovijalne stanice. Stoga su razvijeni modeli za proučavanje složenih interakcija između hrskavice i okolnih tkiva, koji se nazivaju kokulture.
S. Lacombe-Gleise i sur. (1995.) uzgajali su kunićje hondrocite i osteoblaste u sustavu kokulture (COSTAR) u kojem su stanice bile odvojene mikroporoznom membranom (0,4 μm) što je omogućilo izmjenu između dva tipa stanica bez ikakvih izravnih kontakata. Ova studija pokazala je sposobnost osteoblasta da stimuliraju rast hondrocita putem topljivih medijatora.
AM Malfait i koautori (1994.) proučavali su odnos između monocita periferne krvi i hondrocita. Ovaj model je prikladan za proučavanje procesa posredovanih citokinima kod upalnih artropatija (reumatoidni artritis, seronegativni spondiloartritisi itd.). Autori modela odvojili su stanice membranom koja veže proteine s porama promjera 0,4 μm. Studija je pokazala da monociti stimulirani lipopolisaharidom proizvode IL-1 i TNF-a, koji inhibiraju sintezu agrekana hondrocitima i doprinose razgradnji već sintetiziranih agregata agrekana.
K. Tada i sur. (1994.) stvorili su model kokulture u kojem su endotelne stanice u kolagenom (tip I) gelu bile smještene u unutarnju komoru odvojenu od vanjske komore s hondrocitima smještenim u njoj pomoću filtera s veličinom pora od 0,4 μm. U stanju potpune izolacije od vanjske komore, ljudske endotelne stanice formirale su cjevčice u kolagenom gelu u prisutnosti EGF-a ili TGF-a. Kada su obje vrste stanica istovremeno uzgajane, inhibirano je stvaranje cjevčica ovisno o TGF-a od strane endotelnih stanica. Inhibicija ovog procesa hondrocitima djelomično je eliminirana anti-TGF-beta antitijelima. Može se pretpostaviti da TGF-beta koji proizvode hondrociti inhibira vaskularizaciju same hrskavice.
S. Groot i sur. (1994.) istovremeno su uzgajali hondrocite iz hipertrofičnih i proliferativnih zona kosti 16 dana starog mišjeg fetusa s komadićima moždanog tkiva. Nakon 4 dana uzgoja uočena je transdiferencijacija hondrocita u osteoblaste i početak stvaranja osteoida. Nakon 11 dana uzgoja, dio hrskavice zamijenjen je koštanim tkivom, a koštana matrica djelomično je kalcificirana. Neki neuropeptidi i neurotransmiteri koje proizvodi moždano tkivo utječu na metabolizam osteoblasta ili imaju receptore za njih. Među njima su norepinefrin, vazoaktivni crijevni peptid, peptid povezan s genom kalcitonina, supstanca P i somatostatin. Komadići moždanog tkiva uzgajani zajedno s hondrocitima mogu proizvesti neke od navedenih čimbenika sposobnih za induciranje procesa transdiferencijacije hondrocita u osteoblaste.
 [ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
[ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
Utjecaj vanjskih čimbenika na kulturu hondrocita
Utjecaj napetosti kisika na metabolizam hondrocita
U većini slučajeva, kulture hondrocita razvijaju se u uvjetima atmosferskog tlaka kisika. Međutim, dobro je poznato da in vivo hondrociti postoje u hipoksičnim uvjetima, a tlak kisika varira pod različitim patološkim stanjima. Tijekom procesa sazrijevanja uočavaju se značajne promjene u opskrbi krvlju epifiza. Budući da se vaskularizacija razlikuje u različitim zonama ploče rasta, varira i tlak kisika u njima. C. Brighton i R. Heppenstall (1971.) pokazali su da je u tibijalnoj ploči kunića tlak kisika u hipertrofičnoj zoni niži nego u okolnoj hrskavici. Mjerenja nekih metaboličkih parametara pokazala su da hondrociti mogu brzo reagirati na lokalne promjene u koncentraciji kisika. Prije svega, pri niskom tlaku kisika smanjuje se njegova potrošnja hondrocita. Smanjenjem tlaka kisika s 21 na 0,04% povećava se iskorištenje glukoze, povećava se aktivnost glikolitičkih enzima i sinteza mliječne kiseline. Čak i pri niskom tlaku kisika, apsolutna količina ATP-a, ADP-a i AMP-a ostaje stabilna. Ovi podaci ukazuju na to da je metabolizam hondrocita usmjeren na maksimalno očuvanje energije. Međutim, sintetska aktivnost, a time i procesi reparacije, mijenjaju se u hipoksičnim uvjetima.
Visoka napetost kisika također utječe na metabolizam hondrocita, uzrokujući smanjenje sinteze proteoglikana i DNA te razgradnju hrskavičnog matriksa. Ove učinke obično prati stvaranje slobodnih kisikovih radikala.
Utjecaj koncentracije iona i osmotskog tlaka okoline na funkciju hondrocita
U nativnoj hrskavici koncentracija iona značajno se razlikuje od one u drugim tkivima: sadržaj natrija u izvanstaničnom mediju iznosi 250-350 mmol, a osmolarnost 350-450 mosmol. Kada se hondrociti izoliraju iz izvanceličnog tkiva (ECM) i inkubiraju u standardnom mediju (DMEM (Dulbecco's Minimal Essential Medium), osmolarnost je 250-280,7 mosmol), okolina koja okružuje stanice dramatično se mijenja. Osim toga, koncentracija kalcija i kalija u standardnom mediju znatno je niža nego u nativnom tkivu, a koncentracija aniona znatno je veća.
Dodatak saharoze u medij povećava njegovu osmolarnost i inducira prolazno unutarstanično povećanje koncentracije H + i kalcijevih aniona u citosolu. Takve unutarstanične promjene mogu utjecati na procese diferencijacije hondrocita i njihovu metaboličku aktivnost. J. Urban i sur. (1993.) otkrili su da je ugradnja 35 8-sulfata i 3H -prolina izoliranim hondrocitima inkubiranim u standardnom DMEM-u tijekom 2-4 sata bila samo 10% one u nativnom tkivu. Intenzitet sinteze dosegao je maksimum pri osmolarnosti izvanstaničnog medija od 350-400 mosmol i u svježe izoliranim hondrocitima i u eksplantatima hrskavičnog tkiva. Štoviše, volumen hondrocita povećao se za 30-40% nakon stavljanja izoliranih stanica u standardni DMEM određene osmolarnosti. Međutim, pri uzgoju hondrocita u uvjetima nefiziološke osmolarnosti tijekom 12-16 sati, stanice se prilagođavaju novim uvjetima, smanjujući intenzitet biosinteze proporcionalno promjeni osmolarnosti izvanstaničnog okruženja.
P. Borgetti i sur. (1995.) proučavali su utjecaj osmolarnosti izvanstanične sredine na rast, morfologiju i biosintezu svinjskih hondrocita. Autori su pokazali slične biokemijske i morfološke značajke hondrocita uzgajanih u medijima s osmolarnošću od 0,28 i 0,38 mosmola. Pri osmolarnosti sredine od 0,48 mosmola uočeno je smanjenje proliferacije stanica i sinteze proteina tijekom prvih 4-6 sati uzgoja, ali su se ti parametri naknadno oporavili i na kraju dosegli kontrolne vrijednosti. Kada su hondrociti uzgajani u mediju s osmolarnošću od 0,58 mosmola, stanice su izgubile sposobnost održavanja fiziološkog intenziteta proliferativnih procesa, a nakon 6 dana broj hondrocita je značajno smanjen. Pri osmolarnosti sredine od 0,58 mosmola uočena je značajna inhibicija sinteze proteina. Osim toga, kada se uzgajaju u medijima s osmolarnošću od 0,28-0,38 mOsm, hondrociti zadržavaju svoj fiziološki fenotip; pri višoj osmolarnosti (0,48-0,58 mOsm) dolazi do značajnih promjena u morfologiji stanica, što se očituje gubitkom karakterističnog fenotipa, transformacijom hondrocita u stanice slične fibroblastima i gubitkom sposobnosti stanica da sastavljaju matrične proteoglikane. Rezultati ove studije ukazuju na sposobnost hondrocita da reagiraju na ograničene fluktuacije osmolarnosti izvanstanične okoline.
Promjene u koncentraciji drugih iona također mogu utjecati na procese biosinteze u hondrocitima. Dakle, stupanj ugradnje 35S (sulfata) povećava se za polovicu s povećanjem koncentracije kalijevih iona od 5 mmol (koncentracija u standardnom DM EM mediju) do 10 mmol (koncentracija u ECM-u in vivo). Koncentracije kalcija ispod 0,5 mmol poticale su proizvodnju kolagena zrelim goveđim hondrocitima, dok je koncentracija od 1-2 mmol (što odgovara koncentraciji u standardnom DM EM mediju) uzrokovala značajno smanjenje sinteze kolagena. Umjereno povećanje biosinteze uočeno je pri visokim razinama kalcija (2-10 mmol). Različiti kationi sudjeluju u vezanju hondrocita na proteine ECM-a. Dakle, magnezijevi i manganovi ioni omogućuju vezanje na fibronektin i kolagen tipa II, dok kalcijevi ioni ne sudjeluju u vezanju hondrocita na proteine. Dakle, rezultati opisanih studija ukazuju na utjecaj promjena izvanstaničnih iona kalija, natrija, kalcija i osmolarnosti medija na biosintetsku funkciju hondrocita inkubiranih u standardnim medijima.
Utjecaj mehaničkog stresa na metabolizam hondrocita
Imobilizacija zgloba uzrokuje reverzibilnu atrofiju hrskavice, što ukazuje na potrebu za mehaničkim podražajima za normalne metaboličke procese u izvanceličnom mjehuru (ECM). U većini slučajeva, korišteni modeli stanične kulture postoje pod normalnim atmosferskim tlakom. M. Wright i sur. (1996.) pokazali su da mehaničko okruženje utječe na metabolizam hondrocita, a stanični odgovor ovisi o intenzitetu i učestalosti kompresivnog opterećenja. Eksperimenti s opterećenjem na eksplantatima intaktne zglobne hrskavice in vitro pokazali su smanjenje sinteze proteina i proteoglikana pod djelovanjem statičkog opterećenja, dok dinamičko opterećenje stimulira te procese. Točni mehanizmi učinka mehaničkog opterećenja na hrskavicu su složeni i vjerojatno su povezani s deformacijom stanica, hidrostatskim tlakom, osmotskim tlakom, električnim potencijalom i površinskim staničnim receptorima za molekule matrice. Za proučavanje učinka svakog od ovih parametara potrebno je stvoriti sustav u kojem se jedan parametar može neovisno mijenjati. Na primjer, kultura eksplantata nije prikladna za proučavanje deformacije stanica, ali se može koristiti za proučavanje općeg učinka tlaka na metaboličku aktivnost hondrocita. Kompresija hrskavice dovodi do deformacije stanica, a prati je i pojava hidrostatskog gradijenta tlaka, električnog potencijala, protoka tekućine i promjena fizikalno-kemijskih parametara kao što su sadržaj vode u matriksu, gustoća električnog naboja i razina osmotskog tlaka. Deformacija stanica može se proučavati pomoću izoliranih hondrocita uronjenih u agarozni ili kolageni gel.
Razvijeno je nekoliko sustava za proučavanje učinka mehaničke stimulacije na kulturu hondrocita. Neki istraživači koriste sustave u kojima se na staničnu kulturu primjenjuje tlak kroz plinovitu fazu. Tako su JP Veldhuijzen i sur. (1979.), koristeći tlak 13 kPa iznad atmosferskog s niskom frekvencijom (0,3 Hz) tijekom 15 minuta, uočili povećanje sinteze cAMP-a i proteoglikana te smanjenje sinteze DNA. R. Smith i sur. (1996.) pokazali su da povremeno izlaganje kulture primarnih goveđih hondrocita hidrostatskom tlaku (10 MPa) s frekvencijom od 1 Hz tijekom 4 sata uzrokuje povećanje sinteze agrekana i kolagena tipa II, dok konstantni tlak nije utjecao na te procese. Koristeći sličan sustav, Wright i sur. (1996.) izvijestili su da je ciklički tlak na staničnu kulturu povezan s hiperpolarizacijom stanične membrane hondrocita i aktivacijom Ca2 + -ovisnih kalijevih kanala. Dakle, učinci cikličkog tlaka posredovani su istezanjem aktiviranim ionskim kanalima u membrani hondrocita. Odgovor hondrocita na hidrostatski tlak ovisi o uvjetima stanične kulture i učestalosti primijenjenog opterećenja. Dakle, ciklički hidrostatski tlak (5 MPa) smanjuje ugradnju sulfata u monosloj hondrocita pri frekvenciji od 0,05, 0,25 i 0,5 Hz, dok se pri frekvenciji većoj od 0,5 Hz ugradnja sulfata u hrskavični eksplantat povećava.
M. Bushmann i sur. (1992.) izvijestili su da hondrociti u agaroznim gelovima mijenjaju biosintezu kao odgovor na statičko i dinamičko mehaničko opterećenje na isti način kao i kultivirani intaktni organ. Autori su otkrili da mehaničko opterećenje generira hiperosmotski podražaj s naknadnim smanjenjem pH u hondrocitima.
Učinak mehaničkog istezanja može se proučavati na staničnoj kulturi uronjenoj u gel. Sila istezanja može se stvoriti pomoću računalno kontroliranog vakuuma. Kada je sustav pod određenim stupnjem vakuuma, dno Petrijeve zdjelice sa staničnom kulturom se produžava za poznatu količinu, deformacija je maksimalna na rubovima dna zdjelice, a minimalna u sredini. Istezanje se također prenosi na hondrocite uzgajane u Petrijevoj zdjelici. Koristeći ovu metodu, K. Holm-vall i sur. (1995.) pokazali su da se u stanicama hondrosarkoma uzgajanim u kolagenom (tip II) gelu povećava ekspresija mRNA 2β-integrina . 2βintegrinse može vezati za kolagen tipa II. Smatra se mehanoreceptorom, budući da interagira s proteinima koji vežu aktin, povezujući tako izvancelični matični dio (ECM) i citoskelet.
Utjecaj pH na metabolizam hondrocita
PH intersticijske tekućine izvanceličnog matriksa hrskavičnog tkiva je kiseliji nego u drugim tkivima. A. Maroudas (1980.) odredio je pH matrice zglobne hrskavice na 6,9. B. Diamant i sur. (1966.) utvrdili su pH od 5,5 u patološkim uvjetima. Poznato je da hondrociti žive pri niskom PO2, što ukazuje na važnu ulogu glikolize (95% ukupnog metabolizma glukoze) u metabolizmu tih stanica; glikolizu prati stvaranje velike količine mliječne kiseline.
Osim zakiseljavanja okoliša produktima glikolize, same komponente matrice su od velike važnosti. Velika količina fiksnog negativnog naboja na proteoglikanima modificira izvanstanični ionski sastav: opaža se visoka koncentracija slobodnih kationa (npr. H +, Na +, K + ) i niska koncentracija aniona (npr. O2, HCO3). Osim toga, pod utjecajem mehaničkog opterećenja, voda se izbacuje iz izvanstanične mase (ECM), što dovodi do povećanja koncentracije fiksnih negativnih naboja i privlačenja više kationa u matricu. To je popraćeno smanjenjem pH izvanstanične okoline, što utječe na unutarstanični pH, čime se modificira metabolizam hondrocita. R. Wilkin i A. Hall (1995.) proučavali su utjecaj pH izvanstanične i unutarstanične okoline na biosintezu matriksa izoliranim goveđim hondrocitima. Uočili su dvostruku modifikaciju sinteze matriksa sa smanjenjem pH. Blagi pad pH (7,4
 [ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ]
[ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ]
Utjecaj sastava hranjive podloge na metabolizam hondrocita
Medij za uzgoj hondrocita mora odgovarati eksperimentalnim uvjetima. Posljednjih godina teleći serum se koristi za optimizaciju uvjeta uzgoja. Međutim, pri korištenju seruma treba uzeti u obzir niz važnih točaka:
- vanjski rast stanica s periferije tkiva u kulturama organa,
- varijabilnost u sastavu seruma različitih serija,
- prisutnost nepoznatih komponenti u njima,
- povećan rizik od interferencije i artefakata pri proučavanju utjecaja različitih bioloških čimbenika na metaboličku aktivnost stanica.
Primjer potonjeg je studija učinka EGF-a na hrskavične hondrocite kod štakora. EGF je stimulirao ugradnju 3H -timidina i povećanje sadržaja DNA u kulturi. Taj je učinak bio izraženiji pri niskim serumskim koncentracijama (<1%), ali pri visokim koncentracijama (>7,5%) učinak je nestao.
Dobro je poznato da su razine sinteze i razgradnje u DMEM-u nadopunjenom telećim serumom značajno povećane u usporedbi s in vivo uvjetima. Razlike između metabolizma in vivo i in vitro mogu biti posljedica razlika između sinovijalne tekućine i medija u kojem se stanice uzgajaju. Lee i sur. (1997.) uzgajali su mlade goveđe hondrocite u agarozi koristeći hranjivi medij koji sadrži DMEM nadopunjen s 20% telećeg seruma i velikom količinom normalne alogene sinovijalne tekućine. Prisutnost sinovijalne tekućine u mediju izazvala je povećanje količine proteoglikana, do 80% ukupne količine sinovijalne tekućine. Ovi rezultati ukazuju na to da sinovijalna tekućina u kulturi inducira razinu metabolizma sličnu onoj in vivo, s visokom razinom sinteze glikozaminoglikana i niskom razinom stanične diobe.
G. Verbruggen i sur. (1995.) pokazali su da je sinteza 35S -arrpeKaHa od strane ljudskih hondrocita uzgajanih u agarozi u DMEM-u bez seruma bila 20-30% razine sinteze uočene u DMEM-u nadopunjenom s 10% telećeg seruma. Autori su utvrdili u kojoj mjeri IGF-1, IGF-2, TGF-R ili inzulin obnavljaju proizvodnju agrekana u mediju bez seruma. Autori su zaključili da 100 ng/ml inzulina, IGF-1 ili IGF-2 djelomično obnavlja sintezu agrekana na 39-53% kontrolne razine. Nije uočen sinergizam ili kumulacija s kombinacijom navedenih čimbenika. Istovremeno, 10 ng/ml TGF-R u prisutnosti 100 ng/ml inzulina stimulira sintezu agrekana na 90% ili više referentne razine. Konačno, transferin iz ljudskog seruma, sam ili u kombinaciji s inzulinom, nije utjecao na sintezu agrekana. Kada je teleći serum zamijenjen goveđim serumskim albuminom, sadržaj agrekanskih agregata značajno se smanjio. Obogaćivanje podloge za uzgoj inzulinom, IGF-om ili TGF-R djelomično je obnovilo sposobnost stanica da proizvode agrekanske agregate. Štoviše, IGF-1 i inzulin mogu održavati homeostazu u staničnim kulturama. Nakon 40 dana uzgoja u mediju obogaćenom s 10-20 ng/ml IGF-1, sinteza proteoglikana održavala se na istoj ili čak višoj razini u usporedbi s medijem koji sadrži 20% telećeg seruma. Katabolički procesi odvijali su se sporije u mediju obogaćenom IGF-1 nego u mediju obogaćenom s 0,1% otopinom albumina, ali nešto brže u mediju obogaćenom s 20% seruma. U dugoživućim kulturama, 20 ng/ml IGF-1 održava stabilno stanje stanica.
D. Lee i sur. (1993.) usporedili su učinak sastava podloge za uzgoj (DMEM, DMEM+20% telećeg seruma, DMEM+20 ng/ml IGF-1) na sintezu DNA u kulturi eksplantata hrskavičnog tkiva, monoslojnoj kulturi i u agaroznoj suspenziji. Prilikom uzgoja u agarozi u prisutnosti seruma, autori su uočili tendenciju grupiranja hondrocita u velike nakupine. Stanice uzgojene bez seruma ili s IGF-1 zadržale su okrugli oblik u agarozi, skupljene u male skupine, ali nisu formirale velike agregate. U monosloju, sinteza DNA bila je značajno veća u mediju koji sadrži serum nego u mediju obogaćenom s IGF-1; sinteza DNA u potonjem bila je značajno veća nego u neobogaćenom mediju. Nisu pronađene razlike u sintezi DNA kada su hondrociti uzgojeni u agaroznoj suspenziji u neobogaćenom mediju i u mediju s IGF-1. Istovremeno, kultiviranje suspenzija hondrocita u agarozi u mediju obogaćenom serumom bilo je popraćeno povećanom ugradnjom radionukleotida 3H -timidina u usporedbi s drugim medijima.
Vitamin C je neophodan za aktivaciju enzima uključenih u stvaranje stabilne spiralne strukture kolagenih fibrila. Hondrociti kojima nedostaje askorbinska kiselina sintetiziraju nedovoljno hidroksilirane nespiralne prekursore kolagena, koji se sporo izlučuju. Primjena askorbinske kiseline (50 μg/ml) uzrokuje hidroksilaciju kolagena tipova II i IX i njihovo izlučivanje u normalnim količinama. Dodavanje vitamina C nije utjecalo na razinu sinteze proteoglikana. Stoga se izlučivanje kolagena regulira neovisno o izlučivanju proteoglikana.

