Medicinski stručnjak članka
Nove publikacije
Restenoza
Last reviewed: 04.07.2025

Svi iLive sadržaji medicinski se pregledavaju ili provjeravaju kako bi se osigurala što je moguće točnija činjenica.
Imamo stroge smjernice za pronalaženje izvora i samo povezujemo s uglednim medijskim stranicama, akademskim istraživačkim institucijama i, kad god je to moguće, medicinski pregledanim studijama. Imajte na umu da su brojevi u zagradama ([1], [2], itd.) Poveznice koje se mogu kliknuti na ove studije.
Ako smatrate da je bilo koji od naših sadržaja netočan, zastario ili na neki drugi način upitan, odaberite ga i pritisnite Ctrl + Enter.
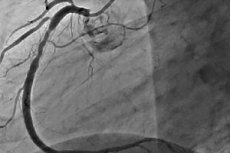
Restenoza je razvoj ponavljajućeg suženja od 50% ili više na mjestu perkutane koronarne intervencije. Restenoza je obično popraćena ponavljajućom anginom pektoris, koja često zahtijeva ponovljene intervencije. Kako se PCI razvijao, incidencija restenoze se smanjila, a promijenila se i njezina priroda.
Restenoza nakon transluminalne balonske koronarne angioplastike (TBCA)
Nakon TBCA, stopa restenoze u prvih 6 mjeseci iznosi 30-40%. Glavni mehanizam njezina razvoja je lokalno negativno remodeliranje žile, što je, u biti, elastični kolaps arterijskog lumena, proširenog balonom tijekom postupka. Lokalno stvaranje tromba i neointimalni rast također igraju relativnu ulogu. Postoje klinički (dijabetes melitus tipa 2, akutni koronarni sindrom (AKS), anamneza restenoze), angiografski (lezija LAD-a, mali promjer žile, kronična potpuna okluzija (KTO), duga lezija, degenerirani venski bypass graftovi) i proceduralni (velika rezidualna stenoza, malo povećanje promjera žile kao posljedica napuhavanja balona) faktori rizika za restenozu nakon TBCA. U slučaju restenoze obično se izvodi ponovljena intervencija. Uspjeh ponovljene TBCA na mjestu restenoze usporediv je s prvim postupkom. Međutim, sa svakom sljedećom TBCA za restenozu, rizik od ponovne restenoze značajno se povećava. Nakon 3. pokušaja doseže 50-53%. Osim toga, sa svakom ponovljenom TBCA, restenoza u razvoju je izraženija od prve. Čimbenici rizika za restenozu nakon druge TBCA za restenozu su rana pojava prve restenoze (60-90 dana nakon postupka), oštećenje LAD-a, oštećenje više krvnih žila, dijabetes melitus tipa 2, arterijska hipertenzija, nestabilna angina pektoris i višestruko napuhavanje balona tijekom prvog postupka. S obzirom na visoku učestalost restenoze i mehanizam njezina razvoja, u kliničku praksu uvedeni su koronarni stentovi, koji su teoretski trebali eliminirati negativno preoblikovanje krvnih žila nakon TBCA.
Prve studije koje su pokazale učinkovitost stenta bile su studije STRESS i BENESTENT objavljene 1993. godine. U studiju BENESTENT uključeno je 516 pacijenata s novodijagnosticiranom stenozom koronarnih arterija promjera većeg od 3 mm, koji su randomizirani u dvije skupine: konvencionalna TBCA (n = 257) i TBCA s postavljanjem stenta (n = 259). Nakon 3 godine, stopa restenoze tijekom angiografije bila je 32% u skupini s konvencionalnom TBCA i 22% u skupini sa stentom. Relativno smanjenje stope restenoze bilo je 31% (p < 0,01). Skupina sa stentom također je imala manju potrebu za ponovljenom revaskularizacijom miokarda (10 naspram 20,6% u skupini s konvencionalnom TBCA; p < 0,01), što je bilo povezano s nižom stopom recidiva angine pektoris u skupini sa stentom.
Prema STRESS studiji (n = 407), stopa restenoze također je bila niža u skupini sa stentiranjem (n ~ 205) nego u skupini s konvencionalnom PTCA (n = 202) - 31,6 prema 42,1% (p < 0,01). Prednost korištenja stentova u odnosu na konvencionalnu angioplastiku u slučaju restenoze na mjestu PTCA-e dokazana je u REST studiji, u kojoj je 383 pacijenta s restenozom randomizirano u skupinu sa stentiranjem ili ponovljenu perkutanu transluminalnu koronarnu angioplastiku. Angiografski otkrivena ponovljena restenoza bila je 18% niža u skupini sa stentiranjem (18 prema 5,32%; p < 0,03). Ponovljena revaskularizacija miokarda, koja je pokazatelj klinički značajne restenoze, također je bila značajno rjeđe potrebna u skupini pacijenata koji su podvrgnuti stentiranju (10 prema 27%; p < 0,001). Dakle, bolji rezultati primjenom stentinga dokazani su ne samo u nativnim arterijama, već i u slučaju intervencije zbog restenoze koja se razvila nakon TBCA.
Restenoza nakon implantacije golog stenta (BSI)
Iako su nepokriveni koronarni stentovi smanjili incidenciju restenoze za 30-40% u usporedbi s TBCA, 17-32% pacijenata razvija restenozu u stentu čak i nakon stenta, što zahtijeva ponovljenu revaskularizaciju. Mehanizam razvoja stenoze u stentu (ISS) razlikuje se od onog kod TBCA. Nakon stenta, glavni doprinos restenozi je stvaranje neointime, a ne negativno remodeliranje, kao kod TBCA, koje praktički nije prisutno na mjestu implantacije stenta. Neointima nastaje migracijom i proliferacijom stanica glatkih mišića koje proizvode izvanstanični matriks, koji zajedno sa stanicama čini neointimu. Osim toga, perzistencija tromba na mjestu stenta također je važna kod pacijenata s dijabetesom.
Glavna klasifikacija in-stent stenoze (ISS) je klasifikacija koju je predložio Mehrаn, a koja uključuje četiri tipa ovisno o opsegu i težini lezije: I tip ISS - lokalni (< 10 mm duljine), II tip - difuzni (> 10 mm duljine), III tip - proliferativni (> 10 mm i proteže se izvan stenta) i IV tip - ISS koja dovodi do okluzije. Prvi tip se dijeli na podtipove ovisno o lokaciji u stentu: 1a - na zavoju ili između stentova, 1b - marginalni, 1c - unutar stenta, 1d - multifokalni.
Čimbenici rizika za razvoj VRS-a su intervencije na venskim bypass graftovima, kronične okluzije, ostijalne lezije, mali promjer žile, prisutnost rezidualne stenoze, stentiranje za VRS, mali promjer žile nakon postupka, LAD lezija, velika duljina stenta, prisutnost dijabetesa, implantacija nekoliko stentova u jednu leziju. Postoje indikacije o utjecaju genetskih čimbenika, posebno polimorfizma gena za glikoprotein IIIa i mutacija gena za metilentetrahidrofolat reduktazu - gena koji kodira interleukin-1. U slučaju razvoja marginalne restenoze stenta, glavni čimbenik rizika je izražena aterosklerotska lezija u stentiranom segmentu.
Restenoza se pretežno javlja tijekom prvih 6-8 mjeseci nakon perkutane koronarne intervencije. Većina pacijenata razvije kliničke simptome otprilike u isto vrijeme. VRS se obično manifestira rekurentnom anginom. Nestabilna angina se javlja rjeđe (11-41% slučajeva). AIM se razvija u 1-6% pacijenata. Dakle, najčešći uzrok angine tijekom razdoblja od 1-6 mjeseci nakon stentiranja je razvoj VRS-a, koji, u pravilu, zahtijeva ponovljenu revaskularizaciju. Postoji nekoliko metoda za liječenje VRS-a. Može se izvesti konvencionalna TBCA, što dovodi do daljnjeg širenja stenta (56% doprinos konačnom povećanju promjera žile) i potiskuje neointimu kroz stanice stenta (44% doprinos konačnom povećanju promjera). Međutim, rezidualna restenoza se uočava u većini slučajeva na mjestu intervencije (u prosjeku 18%). Osim toga, nakon TBCA, ponovljena revaskularizacija je potrebna u 11% slučajeva, češće kod pacijenata s višežilnom bolešću, niskim LVEF-om, u slučaju intervencija na venskim bypass graftovima ili rane pojave prvog VRS-a. Rizik od razvoja ponovljenog VRS-a nakon TBCA također ovisi o vrsti lezije i kreće se od 10% u slučaju lokalne restenoze do 80% u slučaju intra-stent okluzije. Implantacija LES-a na mjestu VRS-a ne smanjuje rizik od njegovog ponovnog pojavljivanja u usporedbi sa samo TBCA.
Druga metoda liječenja VRS-a je brahiterapija koja uključuje uvođenje radioaktivnog izvora u lumen koronarne arterije, sprječavajući proliferaciju glatkih mišićnih stanica i, sukladno tome, smanjujući rizik restenoze. Međutim, visoka cijena opreme, tehnička složenost postupka i povećana incidencija kasne tromboze stenta (LT) gotovo su u potpunosti isključili brahiterapiju iz kliničke primjene.
Revolucionarni trenutak u liječenju VRS-a bilo je uvođenje stentova koji otpuštaju lijekove. U usporedbi s LES-om u nativnim arterijama, oni smanjuju rizik od VRS-a za 70-80%. Prvi podaci o učinkovitosti DES-a kod pacijenata s već razvijenim VRS-om dobiveni su u registru pacijenata TAXUS III, u kojem je, pri korištenju SPG1 kod takvih pacijenata, učestalost recidiva VRS-a bila samo 16% nakon 6 mjeseci, što je niže nego u prethodno spomenutim studijama s TBCA. U registru TRUE, koji je uključivao pacijente nakon implantacije SES-a zbog restenoze LES-a, nakon 9 mjeseci ponovna revaskularizacija bila je potrebna kod manje od 5% pacijenata, uglavnom sa šećernom bolešću i AKS-om. Studija TROPICAL usporedila je učestalost ponovljene restenoze kod pacijenata nakon implantacije DES-a na mjestu restenoze s podacima studija GAMMA I i GAMMA II, u kojima je brahiterapija korištena kao metoda liječenja. Nakon 6 mjeseci, incidencija ponovne restenoze bila je značajno niža u SPS skupini (9,7 naspram 40,3%; p < 0,0001). Važno je napomenuti da je incidencija tromboze stenta i infarkta miokarda također bila niža u SPS skupini (TS 0,6 naspram 3,9%; p = 0,08; MI - 1,8 naspram 9,4%; p = 0,004). Prednost SPS-a u odnosu na brahiterapiju potvrđena je u randomiziranoj SISR studiji, u kojoj je 384 pacijenta s razvijenim VRS-om u NSC-u randomizirano u skupine s brahiterapijom ili implantacijom SPS-a. Nakon 9 mjeseci, potreba za ponovljenom revaskularizacijom bila je veća nakon brahiterapije (19,2%) nego u skupini s implantacijom SPS-a (8,5%), što je odražavalo češću recidiv restenoze. Nakon 3 godine, prednost SPS-a u smislu smanjenja potrebe za ponovljenom revaskularizacijom zbog ponovne restenoze stenta ostala je (19 naspram 28,4%). Nije bilo značajne razlike u učestalosti tromboze između skupina.
Glavni čimbenici za razvoj rekurentne VRS u bolesnika s LES u slučaju implantacije SPS-a su mali promjer žile (< 2,5 mm), difuzni tip restenoze i prisutnost kroničnog zatajenja bubrega koje zahtijeva hemodijalizu. U randomiziranoj studiji TAXUS V ISR, SPS je također pokazao visoku učinkovitost u liječenju VRS-a, smanjujući stopu rekurentne restenoze za 54% u usporedbi s brahiterapijom.
Također su provedena randomizirana ispitivanja koja su uspoređivala učinkovitost TBCA za implantaciju VRS-a i DES-a. U randomiziranom RIBS-II ispitivanju, nakon 9 mjeseci, ponovljena restenoza bila je 72% rjeđa nakon implantacije DES-a nego nakon TBCA-e, što je smanjilo potrebu za ponovnom revaskularizacijom s 30 na 11%. Ispitivanje ISAR DESIRE usporedilo je učinkovitost TBCA-e za VRS s implantacijom SPP-a ili SPS-a. Nakon 6 mjeseci pokazalo se da su oba DES-a bila učinkovitija u sprječavanju ponovljene restenoze od TBCA-e (njezina incidencija bila je 44,6% s TBCA-om, 14,3% u skupini SPS-a i 21,7% u skupini SPS-a), što je smanjilo potrebu za ponovnom revaskularizacijom. U izravnoj usporedbi SPP-a i SPS-a utvrđeno je da SPS značajno učinkovitije smanjuje potrebu za ponovnom revaskularizacijom od SPP-a (8 naspram 19%). Dakle, implantacija DES-a smanjuje incidenciju rekurentnih LES VRS u usporedbi s TBCA i brahiterapijom, što smanjuje broj ponovljenih PCI i stoga čini njihovu implantaciju postupkom izbora kod takvih pacijenata.
Restenoza nakon implantacije stenta koji otpušta lijekove (DES)
Unatoč smanjenju incidencije stenoze u stentu za 70-80% pri korištenju DES-a u usporedbi s LES-om, nisu mogli u potpunosti isključiti razvoj ove jatrogene posljedice stenta. Njegova ukupna incidencija ostaje u prosjeku manja od 10%. Osim kvantitativnog smanjenja incidencije restenoze, značajno su promijenili i vrstu restenoze koja se javlja. Dakle, nakon implantacije DES-a, restenoza je obično fokalna. Klinički se, kao i u slučaju LES-a, najčešće manifestira kao relaps stabilne angine (77%), rjeđe (8%) je asimptomatska. U 5% slučajeva manifestira se kao nestabilna angina, a u 10% joj je prvi simptom infarkt miokarda bez Q vala. Glavni čimbenici u razvoju restenoze DES-a su dijabetes melitus tipa 2, mali promjer krvnih žila i opseg lezije. Ne postoje jasne preporuke za liječenje takvih pacijenata. Alternativne mogućnosti su ponovna implantacija DES-a (istog ili drugog tipa), TBCA ili brahiterapija. Prosječna stopa ponovne restenoze s drugim DES-om je 24%, i ista je bez obzira implantira li se isti tip DES-a ili drugi.


 [
[