Medicinski stručnjak članka
Nove publikacije
Sinteza, sekrecija i metabolizam kateholamina
Posljednji pregledao: 06.07.2025

Svi iLive sadržaji medicinski se pregledavaju ili provjeravaju kako bi se osigurala što je moguće točnija činjenica.
Imamo stroge smjernice za pronalaženje izvora i samo povezujemo s uglednim medijskim stranicama, akademskim istraživačkim institucijama i, kad god je to moguće, medicinski pregledanim studijama. Imajte na umu da su brojevi u zagradama ([1], [2], itd.) Poveznice koje se mogu kliknuti na ove studije.
Ako smatrate da je bilo koji od naših sadržaja netočan, zastario ili na neki drugi način upitan, odaberite ga i pritisnite Ctrl + Enter.
Srž nadbubrežne žlijezde proizvodi spojeve sa strukturom koja je daleko od steroida. Sadrže 3,4-dihidroksifenil (katehol) jezgru i nazivaju se kateholamini. To uključuje adrenalin, noradrenalin i dopamin beta-hidroksitiramin.
Slijed sinteze kateholamina je prilično jednostavan: tirozin → dihidroksifenilalanin (DOPA) → dopamin → norepinefrin → adrenalin. Tirozin ulazi u tijelo hranom, ali se može formirati i iz fenilalanina u jetri pod djelovanjem fenilalanin hidroksilaze. Konačni produkti pretvorbe tirozina u tkivima su različiti. U srži nadbubrežne žlijezde proces napreduje do faze stvaranja adrenalina, u završetcima simpatičkih živaca - norepinefrina, u nekim neuronima središnjeg živčanog sustava sinteza kateholamina završava stvaranjem dopamina.
Pretvorbu tirozina u DOPA katalizira tirozin hidroksilaza, čiji su kofaktori tetrahidrobiopterin i kisik. Vjeruje se da ovaj enzim ograničava brzinu cijelog procesa biosinteze kateholamina i da ga inhibiraju krajnji produkti procesa. Tirozin hidroksilaza je glavna meta regulatornih učinaka na biosintezu kateholamina.
Pretvorbu DOPA-e u dopamin katalizira enzim DOPA dekarboksilaza (kofaktor - piridoksal fosfat), koji je relativno nespecifičan i dekarboksilira druge aromatske L-aminokiseline. Međutim, postoje naznake o mogućnosti modificiranja sinteze kateholamina promjenom aktivnosti ovog enzima. Nekim neuronima nedostaju enzimi za daljnju pretvorbu dopamina, a on je konačni produkt. Druga tkiva sadrže dopamin beta-hidroksilazu (kofaktori - bakar, askorbinska kiselina i kisik), koja pretvara dopamin u norepinefrin. U srži nadbubrežne žlijezde (ali ne i u završetcima simpatičkih živaca) prisutan je feniletanolamin - metiltransferaza koja iz norepinefrina tvori adrenalin. U ovom slučaju, S-adenozilmetionin služi kao donor metilnih skupina.
Važno je zapamtiti da sintezu feniletanolamin-N-metiltransferaze induciraju glukokortikoidi koji ulaze u srž iz korteksa putem portalnog venskog sustava. To može objasniti činjenicu da su dvije različite endokrine žlijezde kombinirane u jednom organu. Važnost glukokortikoida za sintezu adrenalina naglašava činjenica da se stanice srži nadbubrežne žlijezde koje proizvode noradrenalin nalaze oko arterijskih žila, dok stanice koje proizvode adrenalin primaju krv uglavnom iz venskih sinusa smještenih u kori nadbubrežne žlijezde.
Razgradnja kateholamina odvija se uglavnom pod utjecajem dva enzimska sustava: katehol-O-metiltransferaze (COMT) i monoaminooksidaze (MAO). Glavni putevi razgradnje adrenalina i noradrenalina shematski su prikazani na slici 54. Pod utjecajem COMT-a u prisutnosti donora metilne skupine S-adrenosilmetionina, kateholamini se pretvaraju u normetanefrin i metanefrin (3-O-metil derivati noradrenalina i adrenalina), koji se pod utjecajem MAO pretvaraju u aldehide, a zatim (u prisutnosti aldehid oksidaze) u vanililmandelinsku kiselinu (VMA), glavni produkt razgradnje noradrenalina i adrenalina. U istom slučaju, kada su kateholamini u početku izloženi MAO-u, a ne COMT-u, pretvaraju se u 3,4-dioksomandelin aldehid, a zatim, pod utjecajem aldehid oksidaze i COMT-a, u 3,4-dioksomandelinsku kiselinu i VMC. U prisutnosti alkohol dehidrogenaze, iz kateholamina može nastati 3-metoksi-4-oksifenilglikol, koji je glavni krajnji produkt razgradnje adrenalina i noradrenalina u CNS-u.
Razgradnja dopamina je slična, osim što njegovim metabolitima nedostaje hidroksilna skupina na beta-ugljikovom atomu, pa se umjesto vanililmandelinske kiseline stvara homovanilična kiselina (HVA) ili 3-metoksi-4-hidroksifeniloctena kiselina.
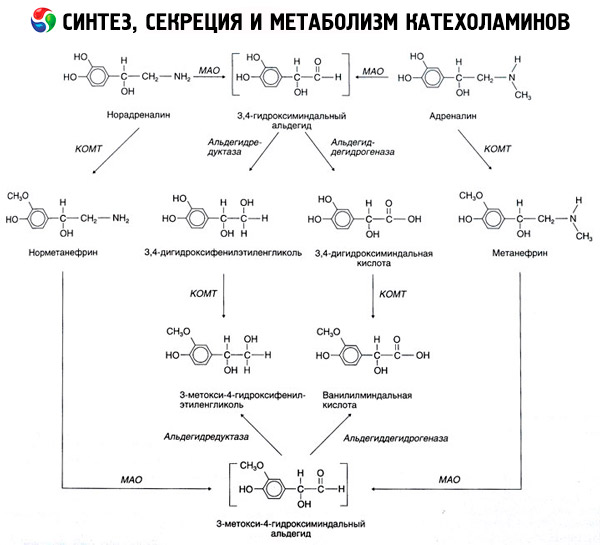
Također se pretpostavlja postojanje kinoidnog puta oksidacije molekule kateholamina, koji može proizvesti međuprodukte s izraženom biološkom aktivnošću.
Norepinefrin i adrenalin nastali pod djelovanjem citosolnih enzima u simpatičkim živčanim završecima i srži nadbubrežne žlijezde ulaze u sekretorne granule, što ih štiti od djelovanja enzima za razgradnju. Hvatanje kateholamina granulama zahtijeva utrošak energije. U kromafinskim granulama srži nadbubrežne žlijezde, kateholamini su čvrsto vezani za ATP (u omjeru 4:1) i specifične proteine - kromogranine, što sprječava difuziju hormona iz granula u citoplazmu.
Izravni poticaj za lučenje kateholamina je očito prodiranje kalcija u stanicu, što potiče egzocitozu (spajanje membrane granula s površinom stanice i njihovo pucanje s potpunim oslobađanjem topljivog sadržaja - kateholamina, dopamin beta-hidroksilaze, ATP-a i kromogranina - u izvanstaničnu tekućinu).
Fiziološki učinci kateholamina i njihov mehanizam djelovanja
Učinci kateholamina započinju interakcijom sa specifičnim receptorima ciljnih stanica. Dok su receptori za hormone štitnjače i steroidne hormone lokalizirani unutar stanica, receptori za kateholamine (kao i acetilkolin i peptidne hormone) prisutni su na vanjskoj površini stanice.
Odavno je utvrđeno da su u odnosu na neke reakcije adrenalin ili noradrenalin učinkovitiji od sintetskog kateholamina izoproterenola, dok je u odnosu na druge učinak izoproterenola superiorniji djelovanju adrenalina ili noradrenalina. Na temelju toga razvijen je koncept o prisutnosti dvije vrste adrenoreceptora u tkivima: alfa i beta, a u nekima od njih može biti prisutan samo jedan od ove dvije vrste. Izoproterenol je najsnažniji agonist beta-adrenoreceptora, dok je sintetski spoj fenilefrin najsnažniji agonist alfa-adrenoreceptora. Prirodni kateholamini - adrenalin i noradrenalin - sposobni su stupiti u interakciju s receptorima obje vrste, ali adrenalin pokazuje veći afinitet za beta-, a noradrenalin - za alfa-receptore.
Kateholamini jače aktiviraju srčane beta-adrenergičke receptore od beta-receptora glatkih mišića, što je omogućilo podjelu beta tipa na podtipove: beta1-receptore (srce, masne stanice) i beta2-receptore (bronhi, krvne žile itd.). Učinak izoproterenola na beta1-receptore premašuje učinak adrenalina i noradrenalina samo 10 puta, dok na beta2-receptore djeluje 100-1000 puta jače od prirodnih kateholamina.
Upotreba specifičnih antagonista (fentolamin i fenoksibenzamin za alfa- i propranolol za beta-receptore) potvrdila je adekvatnost klasifikacije adrenoreceptora. Dopamin je sposoban za interakciju s alfa- i beta-receptorima, ali različita tkiva (mozak, hipofiza, krvne žile) također imaju vlastite dopaminergičke receptore, čiji je specifični blokator haloperidol. Broj beta-receptora varira od 1000 do 2000 po stanici. Biološki učinci kateholamina posredovani beta-receptorima obično su povezani s aktivacijom adenilat ciklaze i povećanjem unutarstaničnog sadržaja cAMP-a. Iako su receptor i enzim funkcionalno povezani, to su različite makromolekule. Gvanozin trifosfat (GTP) i drugi purinski nukleotidi sudjeluju u modulaciji aktivnosti adenilat ciklaze pod utjecajem hormonsko-receptorskog kompleksa. Povećanjem aktivnosti enzima, čini se da smanjuju afinitet beta receptora za agoniste.
Fenomen povećane osjetljivosti denerviranih struktura odavno je poznat. Naprotiv, dugotrajna izloženost agonistima smanjuje osjetljivost ciljnih tkiva. Proučavanje beta receptora omogućilo je objašnjenje tih fenomena. Pokazalo se da dugotrajna izloženost izoproterenolu dovodi do gubitka osjetljivosti adenilat ciklaze zbog smanjenja broja beta receptora.
Proces desenzibilizacije ne zahtijeva aktivaciju sinteze proteina i vjerojatno je posljedica postupnog stvaranja ireverzibilnih hormonsko-receptorskih kompleksa. Naprotiv, uvođenje 6-oksidopamina, koji uništava simpatičke završetke, prati povećanje broja reagirajućih beta-receptora u tkivima. Moguće je da povećanje aktivnosti simpatičkog živčanog sustava također uzrokuje desenzibilizaciju krvnih žila i masnog tkiva povezanu sa starenjem u odnosu na kateholamine.
Broj adrenoreceptora u različitim organima može se kontrolirati drugim hormonima. Dakle, estradiol povećava, a progesteron smanjuje broj alfa-adrenoreceptora u maternici, što je popraćeno odgovarajućim povećanjem i smanjenjem njezinog kontraktilnog odgovora na kateholamine. Ako je unutarstanični "drugi glasnik" nastao djelovanjem agonista beta-receptora svakako cAMP, tada je situacija s obzirom na prijenosnik alfa-adrenergičkih učinaka složenija. Pretpostavlja se postojanje različitih mehanizama: smanjenje razine cAMP-a, povećanje sadržaja cAMP-a, modulacija stanične dinamike kalcija itd.
Za reprodukciju različitih učinaka u tijelu obično su potrebne doze adrenalina koje su 5-10 puta manje od noradrenalina. Iako je potonji učinkovitiji u odnosu na a- i beta1-adrenoreceptore, važno je zapamtiti da su oba endogena kateholamina sposobna za interakciju s alfa- i beta-receptorima. Stoga biološki odgovor određenog organa na adrenergičku aktivaciju uvelike ovisi o vrsti receptora prisutnih u njemu. Međutim, to ne znači da je selektivna aktivacija živčane ili humoralne veze simpatično-adrenalnog sustava nemoguća. U većini slučajeva opaža se povećana aktivnost njegovih različitih veza. Stoga je općeprihvaćeno da hipoglikemija refleksno aktivira srž nadbubrežne žlijezde, dok je smanjenje krvnog tlaka (posturalna hipotenzija) popraćeno uglavnom oslobađanjem noradrenalina iz završetaka simpatičkih živaca.
Adrenoreceptori i učinci njihove aktivacije u različitim tkivima
Sustav, organ |
Vrsta adrenergičkog receptora |
Reakcija |
Kardiovaskularni sustav: |
||
Srce |
Beta |
Povećana frekvencija srca, vodljivost i kontraktilnost |
Arteriole: |
||
Koža i sluznice |
Alfa |
Smanjenje |
Skeletni mišići |
Beta |
Ekspanzija Kontrakcija |
Trbušni organi |
Alfa (više) |
Smanjenje |
Beta |
Proširenje |
|
Vene |
Alfa |
Smanjenje |
Dišni sustav: |
||
Mišići bronha |
Beta |
Proširenje |
Probavni sustav: |
||
Želudac |
Beta |
Smanjene motoričke sposobnosti |
Crijeva |
Alfa |
Kontrakcija sfinktera |
Slezena |
Alfa |
Smanjenje |
Beta |
Opuštanje |
|
Egzokrini pankreas |
Alfa |
Smanjena sekrecija |
Urogenitalni sustav: |
Alfa |
Kontrakcija sfinktera |
Mjehur |
Beta |
Opuštanje mišića izbacivača |
Muški spolni organi |
Alfa |
Ejakulacija |
Oči |
Alfa |
Proširenje zjenica |
Koža |
Alfa |
Povećano znojenje |
Pljuvačne žlijezde |
Alfa |
Izlučivanje kalija i vode |
Beta |
Sekrecija amilaze |
|
Endokrine žlijezde: |
||
Otočići gušterače |
||
Beta stanice |
Alfa (više) |
Smanjeno lučenje inzulina |
Beta |
Povećano lučenje inzulina |
|
Alfa stanice |
Beta |
Povećano lučenje glukagona |
8-ćelija |
Beta |
Povećano lučenje somatostatina |
Hipotalamus i hipofiza: |
||
Somatotrofi |
Alfa |
Povećano lučenje STH-a |
Beta |
Smanjeno lučenje STH-a |
|
Laktotrofi |
Alfa |
Smanjeno lučenje prolaktina |
Tireotrofi |
Alfa |
Smanjena sekrecija TSH |
Kortikotrofi |
Alfa |
Povećano lučenje ACTH-a |
| beta | Smanjena sekrecija ACTH-a | |
Štitna žlijezda: |
||
Folikularne stanice |
Alfa |
Smanjeno lučenje tiroksina |
Beta |
Povećano lučenje tiroksina |
|
Parafolikularne (K) stanice |
Beta |
Povećano lučenje kalcitonina |
Paratireoidne žlijezde |
Beta |
Povećano lučenje PTH-a |
Bubrezi |
Beta |
Povećano lučenje renina |
Želudac |
Beta |
Povećano lučenje gastrina |
BX |
Beta |
Povećana potrošnja kisika |
Jetra |
? |
Povećana glikogenoliza i glukoneogeneza s oslobađanjem glukoze; povećana ketogeneza s oslobađanjem ketonskih tijela |
Masno tkivo |
Beta |
Povećana lipoliza s oslobađanjem slobodnih masnih kiselina i glicerola |
Skeletni mišići |
Beta |
Povećana glikoliza s oslobađanjem piruvata i laktata; smanjena proteoliza sa smanjenjem oslobađanja alanina i glutamina |
Važno je uzeti u obzir da rezultati intravenske primjene kateholamina ne odražavaju uvijek adekvatno učinke endogenih spojeva. To se uglavnom odnosi na norepinefrin, budući da se u tijelu oslobađa uglavnom ne u krv, već izravno u sinaptičke pukotine. Stoga endogeni norepinefrin aktivira, na primjer, ne samo vaskularne alfa receptore (povišen krvni tlak), već i beta receptore srca (povećan broj otkucaja srca), dok unošenje norepinefrina izvana dovodi uglavnom do aktivacije vaskularnih alfa receptora i refleksnog (putem vagusa) usporavanja otkucaja srca.
Niske doze adrenalina aktiviraju uglavnom beta receptore mišićnih žila i srca, što rezultira smanjenjem perifernog vaskularnog otpora i povećanjem srčanog minutnog volumena. U nekim slučajevima, prvi učinak može prevladati, a hipotenzija se razvija nakon primjene adrenalina. U višim dozama, adrenalin također aktivira alfa receptore, što je popraćeno povećanjem perifernog vaskularnog otpora i, na pozadini povećanja srčanog minutnog volumena, dovodi do povećanja arterijskog tlaka. Međutim, njegov učinak na vaskularne beta receptore je također očuvan. Kao rezultat toga, povećanje sistoličkog tlaka premašuje sličan pokazatelj dijastoličkog tlaka (povećanje pulsnog tlaka). Uvođenjem još većih doza, alfa-mimetički učinci adrenalina počinju prevladavati: sistolički i dijastolički tlak rastu paralelno, kao pod utjecajem norepinefrina.
Učinak kateholamina na metabolizam sastoji se od njihovih izravnih i neizravnih učinaka. Prvi se ostvaruju uglavnom putem beta receptora. Složeniji procesi povezani su s jetrom. Iako se povećana glikogenoliza u jetri tradicionalno smatra rezultatom aktivacije beta receptora, postoje i dokazi o sudjelovanju alfa receptora. Neizravni učinci kateholamina povezani su s modulacijom lučenja mnogih drugih hormona, poput inzulina. U učinku adrenalina na njegovo lučenje, alfa adrenergička komponenta jasno prevladava, budući da je dokazano da je svaki stres popraćen inhibicijom lučenja inzulina.
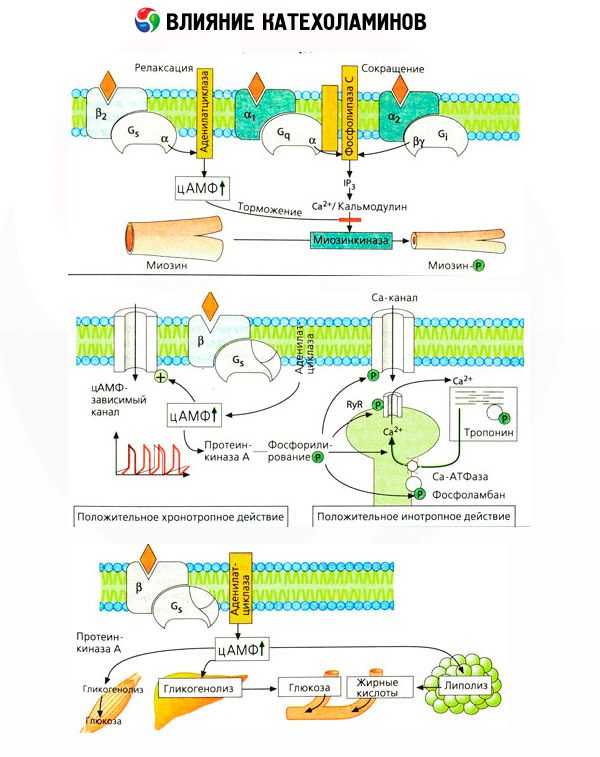
Kombinacija izravnih i neizravnih učinaka kateholamina uzrokuje hiperglikemiju, povezanu ne samo s povećanom proizvodnjom glukoze u jetri, već i s inhibicijom njezine iskorištenosti od strane perifernih tkiva. Ubrzanje lipolize uzrokuje hiperlipacidemiju s povećanom isporukom masnih kiselina u jetru i intenziviranjem proizvodnje ketonskih tijela. Povećana glikoliza u mišićima dovodi do povećanja oslobađanja laktata i piruvata u krv, koji, zajedno s glicerolom oslobođenim iz masnog tkiva, služe kao prekursori jetrene glukoneogeneze.
Regulacija lučenja kateholamina. Sličnost produkata i metoda reakcije simpatičkog živčanog sustava i nadbubrežne medule bila je osnova za kombiniranje tih struktura u jedinstveni simpatičko-adrenalni sustav tijela s izdvajanjem njegovih živčanih i hormonskih veza. Različiti aferentni signali koncentrirani su u hipotalamusu i središtima leđne moždine i produžene moždine, odakle potječu eferentne poruke, prelazeći na stanična tijela preganglijskih neurona smještenih u bočnim rogovima leđne moždine na razini VIII cervikalnog - II-III lumbalnog segmenta.
Preganglijski aksoni ovih stanica napuštaju leđnu moždinu i tvore sinaptičke veze s neuronima smještenim u ganglijima simpatičkog lanca ili sa stanicama nadbubrežne medule. Ova preganglijska vlakna su kolinergička. Prva temeljna razlika između simpatičkih postganglijskih neurona i kromafinskih stanica nadbubrežne medule je u tome što potonje prenose kolinergički signal koji primaju ne živčanom provodljivošću (postganglijski adrenergički živci), već humoralnim putem, oslobađajući adrenergičke spojeve u krv. Druga razlika je u tome što postganglijski živci proizvode norepinefrin, dok stanice nadbubrežne medule proizvode uglavnom adrenalin. Ove dvije tvari imaju različite učinke na tkiva.

