Medicinski stručnjak članka
Nove publikacije
Virus humane imunodeficijencije (HIV)
Posljednji pregledao: 04.07.2025

Svi iLive sadržaji medicinski se pregledavaju ili provjeravaju kako bi se osigurala što je moguće točnija činjenica.
Imamo stroge smjernice za pronalaženje izvora i samo povezujemo s uglednim medijskim stranicama, akademskim istraživačkim institucijama i, kad god je to moguće, medicinski pregledanim studijama. Imajte na umu da su brojevi u zagradama ([1], [2], itd.) Poveznice koje se mogu kliknuti na ove studije.
Ako smatrate da je bilo koji od naših sadržaja netočan, zastario ili na neki drugi način upitan, odaberite ga i pritisnite Ctrl + Enter.
Sindrom stečene imunodeficijencije identificiran je kao specifična bolest 1981. godine u Sjedinjenim Državama, kada je broj mladih ljudi razvio ozbiljne bolesti uzrokovane mikroorganizmima koji su bili nepatogeni ili slabo patogeni za zdrave ljude. Proučavanje imunološkog statusa pacijenata otkrilo je nagli pad broja limfocita općenito, a posebno T-pomagačkih stanica. Ovo stanje nazvano je AIDS (sindrom stečene imunodeficijencije). Način infekcije (spolni kontakt, putem krvi i njezinih pripravaka) ukazivao je na zaraznu prirodu bolesti.
Uzročnika AIDS-a neovisno su 1983. godine otkrili Francuz L. Montagnier, koji ga je nazvao LAV virusom povezanim s limfoadenopatijom, budući da ga je pronašao kod pacijenta s limfadenopatijom; i Amerikanac R. Gallo, koji je virus nazvao HTLV-III (Human T-lymphoadenopatija virus III): prethodno je otkrio limfotropne viruse I i II.
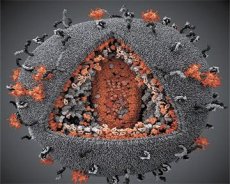
Usporedba svojstava virusa LAV i HTLV-III pokazala je njihovu identičnost, pa je, kako bi se izbjegla zabuna, virus 1986. godine nazvan HIV (virus humane imunodeficijencije ili HIV). HIV je sfernog oblika, promjera 110 nm. Ovojnica virusa ima oblik poliedra, sastavljenog od 12 peterokuta i 20 šesterokuta. U središtu i kutovima svakog šesterokuta nalazi se molekula glikoziliranog proteina gpl20 (broj 120 označava molekularnu težinu proteina u kilodaltonima). Ukupno 72 molekule gpl20 nalaze se na površini viriona u obliku osebujnih šiljaka, od kojih je svaki povezan s intramembranskim proteinom gp41. Ovi proteini, zajedno s dvostrukim lipidnim slojem, tvore superkapsidu (membranu) viriona.
Proteini gpl20 i gp41 nastaju rezanjem proteina prekursora Env staničnom proteazom. Protein gp41 tvori šiljastu "stabljiku" vezanjem svojom citoplazmatskom domenom na protein matrice p17MA koji se nalazi neposredno ispod ovojnice. Molekule p17 međusobno djeluju tijekom sazrijevanja viriona kako bi formirale ikosaedar ispod ovojnice.
U središnjem dijelu viriona, protein p24 tvori kapsidu u obliku konusa. Suženi dio kapside povezan je s membranom viriona uz sudjelovanje proteina rb. Unutar kapside nalaze se dvije identične molekule virusne genomske RNA. Svojim 5' krajevima povezane su s nukleokapsidnim proteinom p7NC. Ovaj protein je zanimljiv jer ima dva aminokiselinska ostatka (motiva) bogata cisteinom i histidinom te sadrže atom Zn - nazivaju se "cinkovi prsti" jer hvataju molekule genomske RNA za uključivanje u virione koji se formiraju. Kapsida također sadrži tri enzima. Revertaza (RT), ili pol kompleks, uključuje reverznu transkriptazu, RNazu H i DNA-ovisnu DNA polimerazu. Revertaza je prisutna kao heterodimer p66/p51. Proteaza (PR) - p10, pokreće i provodi proces sazrijevanja viriona. Integraza (IN) - p31, ili endonukleaza, osigurava uključivanje provirusne DNA u genom stanice domaćina. Kapsida također sadrži molekulu početne RNA (tRNA1"3).
RNA genom u stanici se uz pomoć reverzne transkriptaze pretvara u DNA genom (DNA provirus), koji se sastoji od 9283 nukleotidnih para. S lijeve i desne strane omeđen je takozvanim dugim terminalnim ponavljanjima ili LTR-ovima: S'-LTR s lijeve i 3'-LTR s desne strane. LTR-ovi sadrže po 638 nukleotidnih parova.
Genom HIV-a sastoji se od 9 gena, od kojih se neki preklapaju na krajevima (imaju nekoliko okvira za čitanje) i imaju egzonintronsku strukturu. Oni kontroliraju sintezu 9 strukturnih i 6 regulatornih proteina.
Važnost LTR-ova za virusni genom je u tome što sadrže sljedeće regulatorne elemente koji kontroliraju njegovo funkcioniranje:
- transkripcijski signal (promotorska regija);
- signal adicije poli-A;
- signal zatvaranja;
- integracijski signal;
- signal pozitivne regulacije (TAR za TAT protein);
- negativni regulatorni element (NRE za NEF protein);
- mjesto za vezanje primera RNA (tRNA™3) za sintezu minus-lanca DNA na 3' kraju; signal na 5' kraju LTR-a koji služi kao primer za sintezu plus-lanca DNA.
Osim toga, LTR sadrži elemente uključene u regulaciju spajanja mRNA, pakiranja molekula vRNA u kapsidu (Psi element). Konačno, tijekom transkripcije genoma, u dugim mRNA se formiraju dva signala za REV protein, koji prebacuju sintezu proteina: CAR - za regulatorne proteine i CRS - za strukturne proteine. Ako se REV protein veže na CAR, sintetiziraju se strukturni proteini; ako ga nema, sintetiziraju se samo regulatorni proteini.
Sljedeći regulatorni geni i njihovi proteini igraju posebno važnu ulogu u regulaciji funkcioniranja virusnog genoma:
- TAT protein, koji provodi pozitivnu kontrolu virusne replikacije i djeluje putem TAR regulatorne regije;
- NEV i VPU proteini, koji vrše negativnu kontrolu replikacije kroz NRE regiju;
- REV protein, koji provodi pozitivno-negativnu kontrolu. REV protein kontrolira rad gena gag, pol, env i provodi negativnu regulaciju spajanja.
Dakle, replikacija HIV-a je pod trostrukom kontrolom - pozitivnom, negativnom i pozitivno-negativnom.
VIF protein određuje infektivnost novosintetiziranog virusa. Povezan je s kapsidnim proteinom p24 i prisutan je u virionu u količini od 60 molekula. NEF protein je u virionu predstavljen malim brojem molekula (5-10), moguće povezanih s ovojnicom.
VPR protein inhibira stanični ciklus u G2 fazi, sudjeluje u transportu preintegracijskih kompleksa u staničnu jezgru, aktivira neke virusne i stanične gene te povećava učinkovitost replikacije virusa u monocitima i makrofagima. Lokacija VPR, TAT, REV i VPU proteina u virionu nije utvrđena.
Osim vlastitih proteina, virionska membrana može sadržavati i neke proteine stanice domaćina. VPU i VPR proteini sudjeluju u regulaciji virusne reprodukcije.
Antigenske varijante virusa humane imunodeficijencije (HIV)
Virus humane imunodeficijencije (HIV) je vrlo varijabilan. Čak i iz tijela jednog pacijenta mogu se izolirati sojevi virusa koji se značajno razlikuju po antigenim svojstvima. Takvu varijabilnost olakšava intenzivno uništavanje CD4+ stanica i snažan odgovor antitijela na HIV infekciju. Novi oblik HIV-a, HIV-2, biološki blizak HIV-1, ali imunološki različit od njega, izoliran je od pacijenata iz zapadne Afrike. Homologija primarne strukture genoma ovih virusa je 42%. DNA provirus HIV-2 sadrži 9671 bp, a njegov LTR - 854 bp. HIV-2 je naknadno izoliran u drugim regijama svijeta. Ne postoji unakrsni imunitet između HIV-1 i HIV-2. Poznata su dva velika oblika HIV-1: O (Outlier) i M (Major), potonji je podijeljen u 10 podtipova (AJ). Osam podtipova (AH) cirkulira u Rusiji.
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
Mehanizam interakcije HIV-a sa stanicom
Nakon što prodre u tijelo, virus prvo napada stanice koje sadrže CD4 receptor specifičan za njega. Ovaj receptor prisutan je u velikim količinama u T-pomagačkim stanicama, u manjim količinama u makrofagima i monocitima, a T-pomagačke stanice su posebno osjetljive na virus.
Virus humane imunodeficijencije (HIV) prepoznaje CD4 receptore pomoću svog proteina gpl20. Proces interakcije HIV-a sa stanicom odvija se prema sljedećoj shemi: adsorpcija posredovana receptorom -> obložena jama -> obložena vezikula -> lizosom. U njoj se virionska membrana spaja s lizosomskom membranom, a nukleokapsida, oslobođena od superkapside, ulazi u citoplazmu; na putu do jezgre se uništava, a genomska RNA i pridružene komponente jezgre se oslobađaju. Zatim reverzna transkriptaza sintetizira minus lanac DNA na virionskoj RNA, zatim RNase H uništava virionsku RNA, a virusna DNA polimeraza sintetizira plus lanac DNA. 5'-LTR i 3'-LTR nastaju na krajevima DNA provirusa. DNA provirus može neko vrijeme ostati u jezgri u neaktivnom obliku, ali prije ili kasnije se integrira u kromosom ciljne stanice uz pomoć svoje integraze. U njemu provirus ostaje neaktivan sve dok se dani T-limfocit ne aktivira mikrobnim antigenima ili drugim imunokompetentnim stanicama. Aktivaciju stanične transkripcije DNA regulira poseban nuklearni faktor (NF-kB). To je protein koji veže DNA i proizvodi se u velikim količinama tijekom aktivacije i proliferacije T-limfocita i monocita. Ovaj protein veže se na određene sekvence stanične DNA i slične LTR sekvence DNA provirusa te inducira transkripciju i stanične DNA i DNA provirusa. Induciranjem transkripcije DNA provirusa provodi se prijelaz virusa iz neaktivnog stanja u aktivno i, sukladno tome, iz perzistentne infekcije u produktivnu. Provirus može ostati u neaktivnom stanju vrlo dugo. Aktivacija virusa kritičan je trenutak u njegovoj interakciji sa stanicom.
Od trenutka kada virus prodre u stanicu, počinje razdoblje HIV infekcije - stanje nosioca virusa, koje može trajati 10 ili više godina; a od trenutka aktivacije virusa počinje bolest - AIDS. Uz pomoć svojih regulatornih gena i njihovih produkata, virus se počinje aktivno razmnožavati. TAT protein može povećati brzinu reprodukcije virusa za 1000 puta. Virusna transkripcija je složena. Uključuje stvaranje i pune i subgenomske mRNA, spajanje mRNA, a zatim dolazi do sinteze strukturnih i regulatornih proteina.
Sinteza strukturnih proteina odvija se na sljedeći način. Prvo se sintetizira prekursorski poliprotein Pr55Gag (protein molekularne težine 55 kDa). Sadrži 4 glavne domene: matricu (MA), kapsidu (CA), nukleokapsidu (NC) i rb domenu, iz koje se, kao rezultat rezanja Pr55Gag virusnom proteazom (sam se odvaja od drugog prekursorskog proteina, Gag-Pol), formiraju strukturni proteini p17, p24, p7 i rb. Formiranje poliproteina Pr55Gag glavni je uvjet za formiranje virusnih čestica. Upravo taj protein određuje program morfogeneze viriona. On sekvencijalno uključuje faze transporta Gag poliproteina do plazma membrane, interakcije s njom i interakcije protein-protein tijekom formiranja virusne čestice i njezinog pupanja. Pr55Gag se sintetizira na slobodnim poliribosomima; molekule proteina transportiraju se do membrane, gdje se usidre svojim hidrofobnim regijama. CA domena igra glavnu ulogu u stvaranju nativne konformacije Gag proteina. NC domena osigurava uključivanje (uz pomoć svojih "cinkovih prstiju") 2 molekule genomske RNA u sastav virusne čestice koja se formira. Molekula poliproteina u početku dimerizira zbog interakcije matričnih domena. Zatim se dimeri kombiniraju u heksamerne (od 6 jedinica) komplekse kao rezultat interakcije CA i NC domena. Konačno, heksameri, spajajući se na svojim bočnim površinama, tvore nezrele sferne virione, unutar kojih se nalazi genomska virusna RNA, uhvaćena NC domenom.
Drugi prekursorski protein, Prl60Gag-Pol (protein molekularne težine 160 kDa), sintetizira se kao rezultat pomaka okvira čitanja ribosomom tijekom translacije 3'-kraja gag gena u regiji koja se nalazi neposredno uzvodno od regije koja kodira rb protein. Ovaj Gag-Pol poliprotein sadrži nepotpunu sekvencu Gag proteina (1-423 aminokiseline) i Pol sekvence koje uključuju PR, RT i IN domene. Molekule Gag-Pol poliproteina također se sintetiziraju na slobodnim poliribosomima i transportiraju se do plazma membrane. Poliprotein Prl60Gagpol sadrži sva mjesta intermolekularne interakcije i mjesta vezanja na membranu svojstvena Gag poliproteinu. Stoga se molekule Gag-Pol poliproteina spajaju s membranom i, zajedno s Gag molekulama, uključuju u formirajuće virione, što rezultira pojavom aktivne proteaze i početkom procesa sazrijevanja viriona. HIV-1 proteaza je vrlo aktivna samo u obliku dimera, stoga je za njezino samoizrezivanje iz Prl60Gag-Pol potrebna dimerizacija tih molekula. Sazrijevanje viriona sastoji se od činjenice da oslobođena aktivna proteaza reže prl60Gag-Pol i Gag55 na mjestima koja prepoznaje; nastaju proteini p17, p24, p7, p6, revertaza, integraza i dolazi do njihovog povezivanja u virusnu strukturu.
Env protein se sintetizira na ribosomima povezanim s membranama endoplazmatskog retikuluma, zatim se glikozilira, stanična proteaza ga reže na gp120 i gp41 te transportira na površinu stanice. U tom slučaju, gp41 prodire kroz membranu i veže se na matrične domene molekule Gag proteina povezane s unutarnjom površinom membrane. Ova veza je sačuvana u zrelom virionu.
Dakle, sastavljanje virusnih čestica sastoji se od agregacije prekursorskih proteina i pridruženih molekula RNA na plazmatskoj membrani stanice domaćina, stvaranja nezrelih viriona i njihovog oslobađanja pupanjem s površine stanice. Tijekom pupanja, virion se okružuje staničnom membranom u koju su ugrađene molekule gp41 i gp120. Tijekom pupanja ili, eventualno, nakon oslobađanja viriona, dolazi do njihovog sazrijevanja, koje se provodi uz pomoć virusne proteaze i sastoji se od proteolitičkog rezanja prekursorskih proteina Pr55Gag i Prl60Gag-Pol u proteine zrelog virusa i njihovog povezivanja u određene strukturne komplekse. Vodeću ulogu u procesima virusne morfogeneze igra prekursorski poliprotein Pr55Gag, koji organizira i sastavlja nezreli virion; proces njegovog sazrijevanja dovršava specifična virusna proteaza.
Uzroci imunodeficijencije
Jedan od glavnih uzroka imunodeficijencije kod HIV infekcije je masovna smrt T-pomagačkih stanica. Nastaje kao rezultat sljedećih događaja. Prvo, T-pomagačke stanice zaražene virusom umiru zbog apoptoze. Vjeruje se da su kod oboljelih od AIDS-a replikacija virusa, apoptoza i smanjenje broja T-pomagačkih stanica međusobno povezani. Drugo, T-ubojice prepoznaju i uništavaju T-stanice zaražene virusom ili koje nose adsorbirane molekule gpl20, kao i T-pomagačke stanice zaražene i nezaražene virusom, koje tvore simplaste (sincicij) koji se sastoje od nekoliko desetaka stanica (neke od njih umiru kao rezultat reprodukcije virusa u njima). Kao rezultat uništenja velikog broja T-pomagačkih stanica, dolazi do smanjenja ekspresije membranskih receptora u B-limfocitima za interleukin-2, poremećena je sinteza različitih interleukina (faktori rasta i diferencijacije B-limfocita - IL-4, IL-5, IL-6 itd.), što rezultira poremećajem funkcije T-ubojičkog sustava. Aktivnost komplementa i makrofagnog sustava je potisnuta. Makrofagi i monociti zaraženi virusom dugo ne umiru, ali nisu u stanju ukloniti virus iz tijela. Konačno, zbog strukturne i antigenske sličnosti gpl20 s receptorima nekih epitelnih stanica tijela (uključujući trofoblastne receptore koji posreduju u prijenosu HIV-a putem transplantacije), sintetiziraju se antireceptorska antitijela širokog spektra djelovanja. Takva antitijela mogu blokirati različite stanične receptore i komplicirati tijek bolesti autoimunim poremećajima. Posljedica HIV infekcije je poraz svih glavnih karika imunološkog sustava. Takvi pacijenti postaju bespomoćni protiv širokog spektra mikroorganizama. To dovodi do razvoja oportunističkih infekcija i tumora. Za pacijente s HIV infekcijom povećan je rizik od razvoja najmanje tri vrste raka: Kaposijevog sarkoma; karcinoma (uključujući rak kože); B-staničnog limfoma, koji nastaje zbog maligne transformacije B-limfocita. Međutim, HIV nije samo limfocitotropan, već i neurotropan. Prodire u stanice središnjeg živčanog sustava (astrocite) i endocitozom posredovanom receptorima i fagocitozom limfoblasta zaraženih virusom pomoću astrocita. Kada virus interagira s astrocitima, stvaraju se i simplasti koji olakšavaju širenje patogena kroz međustanične kanale. Virus može dugo perzistirati u makrofagima i monocitima, pa oni služe kao njegov rezervoar i distributer u tijelu, sposoban prodrijeti u sva tkiva. Zaraženi makrofagi igraju glavnu ulogu u unošenju HIV-a u središnji živčani sustav i njegovom oštećenju. U 10% pacijenata primarni klinički sindromi povezani su s oštećenjem središnjeg živčanog sustava i manifestiraju se kao demencija. Dakle, osobe zaražene HIV-om karakteriziraju 3 skupine bolesti - oportunističke infekcije,tumorske bolesti i oštećenja središnjeg živčanog sustava.
Epidemiologija HIV infekcije
Izvor HIV infekcije je isključivo osoba - bolesna osoba ili nositelj virusa. Virus humane imunodeficijencije (HIV) nalazi se u krvi, spermi, cervikalnoj tekućini; kod dojilja - u majčinom mlijeku. Infekcija se događa spolnim putem, putem krvi i njezinih pripravaka, kao i s majke na dijete prije, tijekom i nakon poroda. Slučajevi zaraze virusom putem hrane, pića i uboda insekata nisu poznati.
Ovisnost o drogama doprinosi širenju AIDS-a. Incidencija HIV-a raste svake godine. Prema WHO-u, od 1980. do 2000. godine 58 milijuna ljudi zaraženo je HIV-om. Samo u 2000. godini u svijetu je zaraženo 5,3 milijuna ljudi, a 3 milijuna ljudi umrlo je od AIDS-a. Od 1. siječnja 2004. godine u Rusiji je registrirano 264 tisuće HIV-om zaraženih osoba. Polovica osoba zaraženih HIV-om umire unutar 11-12 godina od trenutka infekcije. Početkom 2004. godine, od svakih 100 tisuća građana Rusije, oko 180 živjelo je s dijagnozom "HIV infekcije". Predviđa se da će s ovom razinom morbiditeta ukupan broj HIV-om zaraženih osoba u Rusiji do 2012. godine biti 2,5-3 milijuna ljudi. Složenost borbe protiv HIV infekcije ovisi o nizu razloga: prvo, ne postoje učinkovite metode liječenja i specifične prevencije; drugo, inkubacijsko razdoblje za HIV infekciju može premašiti 10 godina. Njegovo trajanje ovisi o trenutku aktivacije T-limfocita i DNA provirusa sadržanog u njegovom kromosomu. Još uvijek nije jasno je li svatko zaražen virusom osuđen na AIDS ili je moguće dugotrajno nošenje virusa bez bolesti (što se čini malo vjerojatnim). Konačno, postoji nekoliko virusa ljudske imunodeficijencije (HIV-1, HIV-2), čije antigenske razlike sprječavaju stvaranje unakrsne imunosti. Otkriće virusa simijanske imunodeficijencije (SIV) bacilo je svjetlo na pitanje podrijetla HIV-a. SIV je sličan HIV-u po svojoj organizaciji genoma, ali se značajno razlikuje po nukleotidnom slijedu. HIV-2 zauzima međupoložaj između HIV-1 i SIV-a po svojim serološkim svojstvima, a bliži je SIV-u po nukleotidnom slijedu. U tom smislu, VM Ždanov je sugerirao da virusi HIV-1, HIV-2 i SIV potječu od zajedničkog pretka. Moguće je, prema R. Gallu, da je jedan od SIV-ova nekako ušao u ljudsko tijelo, gdje je prošao kroz niz mutacija, što je rezultiralo pojavom HIV-1, HIV-2 i njegovih drugih oblika.
Simptomi HIV infekcije
Virus humane imunodeficijencije ima neke značajke koje uvelike određuju patogenezu bolesti. Virus ima vrlo visoku stopu reprodukcije, određenu njegovim regulatornim elementima (u aktivnoj fazi sintetizira se do 5000 viriona u 5 minuta). Zbog prisutnosti fuzijskog proteina (gp41), virus inducira stvaranje opsežnih sincicijskih struktura uslijed fuzije zaraženih i nezaraženih T-pomagačkih stanica, što rezultira njihovom masovnom smrću. Molekule proteina gpl20 nastale u velikim količinama slobodno cirkuliraju u krvi i vežu se za receptore nezaraženih T-pomagačkih stanica, zbog čega ih T-ubojice također prepoznaju i uništavaju. Virus se može širiti međustaničnim kanalima od stanice do stanice, u kojem slučaju postaje teško dostupan antitijelima.
Klinički kriteriji za HIV infekciju
Kod odraslih se HIV infekcija dijagnosticira kada imaju najmanje dva ozbiljna simptoma u kombinaciji s najmanje jednim blagim simptomom i u odsutnosti drugih poznatih uzroka imunodeficijencije (rak, kongenitalna imunodeficijencija, teško gladovanje itd.). Ozbiljni simptomi uključuju:
- gubitak težine od 10% ili više;
- produljeno febrilno stanje, povremeno ili stalno;
- kronični proljev.
Manji simptomi: uporni kašalj, generalizirani dermatitis, rekurentni herpes zoster, oralna i faringealna kandidijaza, kronični herpes simpleks, generalizirana limfadenopatija. Dijagnoza AIDS-a postavlja se u prisutnosti samo Kaposijevog sarkoma, kriptokoknog meningitisa, pneumocistne pneumonije. Na kliničku sliku bolesti utječe popratna oportunistička infekcija.
Metode uzgoja virusa humane imunodeficijencije (HIV-a)
HIV-1 i HIV-2 mogu se uzgajati u stanicama samo jednog klona TCV4 limfocita - H9, dobivenog iz leukemijskih TCV4 limfocita. U te se svrhe mogu koristiti i monoslojne kulture astrocitnih stanica, u kojima se HIV-1 dobro reproducira. Među životinjama, čimpanze su osjetljive na HIV-1.
Otpornost virusa u vanjskom okruženju je niska. Umire pod utjecajem sunčeve svjetlosti i UV zračenja, uništava se na 80 °C unutar 30 minuta, a tretiranjem uobičajeno korištenim dezinficijensima - unutar 20-30 minuta. Za dezinfekciju materijala koji sadrži virus potrebno je koristiti mikobaktericidna dezinficijensa, budući da su učinkovita protiv mikroorganizama s najvećom otpornošću.
Laboratorijska dijagnostika HIV infekcije
Glavna metoda za dijagnosticiranje virusonosilaštva i HIV infekcije je enzimski imunološki test. Međutim, zbog činjenice da gpl20 ima strukturnu i antigensku sličnost s receptorima nekih ljudskih stanica, uključujući receptore koji prenose imunoglobuline kroz epitelne stanice sluznica, u tijelu se mogu pojaviti antitijela povezana s antitijelima protiv gpl20. U tom slučaju mogu postojati lažno pozitivni ELISA rezultati. Stoga se svi pozitivno reagirajući serumi ispitanika podvrgavaju dodatnoj analizi imunoblot metodom ili Western blot metodom. Ova metoda temelji se na identifikaciji proučavanih antitijela nakon njihovog elektroforetskog odvajanja i naknadnog testiranja pomoću obilježenih anti-species antitijela. Virološka metoda se rijetko koristi zbog složenosti kultiviranja virusa. Klon limfocita H9 koristi se za dobivanje virusnih antigena - potrebnih komponenti dijagnostičkih testnih sustava. CPR metoda omogućuje otkrivanje virusa u ranoj fazi viremije.
Liječenje HIV infekcije
Potrebno je pronaći ili sintetizirati lijekove koji učinkovito potiskuju aktivnost reverzne transkriptaze (revertaze) ili virusne proteaze. Oni bi spriječili stvaranje DNA provirusa i/ili inhibirali unutarstanično razmnožavanje virusa. Suvremena strategija liječenja HIV-om zaraženih pacijenata temelji se na principu kombinirane upotrebe lijekova koji inhibiraju virusnu proteazu (jedan od lijekova) i reverzazu (2 različita lijeka) - kombinirana (trostruka) terapija. U Rusiji se za liječenje HIV-om zaraženih pacijenata preporučuje kombinirana upotreba 2 domaća lijeka: fosfazida i kriksivana, koji specifično potiskuju reprodukciju HIV-a u ranim i kasnim fazama reprodukcije, posebno sa smanjenom aktivnošću azidotimidina.
Problem specifične profilakse je potreba stvaranja cjepiva koje bi osiguralo stvaranje učinkovitog staničnog imuniteta temeljenog na citotoksičnim limfocitima specifičnim za virus bez značajne proizvodnje antitijela. Takav imunitet osiguravaju Thl pomagači. Moguće je da antitijela, uključujući i ona koja neutraliziraju virus, nisu samo neučinkovita u suzbijanju HIV infekcije, već u visokoj mjeri potiskuju staničnu imunost. Stoga cjepivo protiv HIV-a mora prije svega ispuniti dva glavna zahtjeva: a) biti apsolutno sigurno i b) stimulirati aktivnost T-citotoksičnih limfocita. Proučava se učinkovitost različitih varijanti cjepiva dobivenih od ubijenih (inaktiviranih) virusa i od pojedinačnih antigena s visokim zaštitnim svojstvima. Takvi antigeni mogu se izolirati iz samih viriona ili kemijski sintetizirati. Predloženo je cjepivo stvoreno na temelju metoda genetskog inženjeringa. Riječ je o rekombinantnom virusu vakcinije koji nosi HIV gene odgovorne za sintezu antigena s jakim imunogenim svojstvima. Pitanje učinkovitosti ovih cjepiva zahtijeva znatno vrijeme zbog dugog razdoblja inkubacije HIV infekcije i velike varijabilnosti patogena. Stvaranje visoko učinkovitog cjepiva protiv HIV-a hitan je temeljni problem.

