Medicinski stručnjak članka
Nove publikacije
Uzroci i patogeneza difterije
Posljednji pregledao: 04.07.2025

Svi iLive sadržaji medicinski se pregledavaju ili provjeravaju kako bi se osigurala što je moguće točnija činjenica.
Imamo stroge smjernice za pronalaženje izvora i samo povezujemo s uglednim medijskim stranicama, akademskim istraživačkim institucijama i, kad god je to moguće, medicinski pregledanim studijama. Imajte na umu da su brojevi u zagradama ([1], [2], itd.) Poveznice koje se mogu kliknuti na ove studije.
Ako smatrate da je bilo koji od naših sadržaja netočan, zastario ili na neki drugi način upitan, odaberite ga i pritisnite Ctrl + Enter.
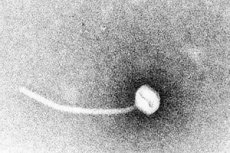
Difterija je paradigma toksigenih zaraznih bolesti. Godine 1883. Klebs je pokazao da je Corynebacterium diphtheriae uzročnik difterije. Godinu dana kasnije, Loeffler je otkrio da se organizam može uzgajati samo iz nazofaringealne šupljine i pretpostavio da je oštećenje unutarnjih organa posljedica topljivog toksina. Do 1888. Roux i Yersin su pokazali da životinje kojima su ubrizgani sterilni filtrati C. diphtheriae razvijaju patologiju organa nerazlučivu od one kod ljudske difterije; to je pokazalo da je snažan egzotoksin glavni faktor virulencije.
Difterija je najčešće infekcija gornjih dišnih putova koja uzrokuje vrućicu, grlobolju i malaksalost. Debela, sivozelena fibrinska membrana, pseudomembrana, često se formira na mjestu (mjestima) infekcije kao rezultat kombiniranog djelovanja rasta bakterija, proizvodnje toksina, nekroze tkiva u podlozi i imunološkog odgovora domaćina. Prepoznavanje da je sistemsko oštećenje organa posljedica djelovanja difterijskog toksina dovelo je do razvoja učinkovite terapije na bazi antitoksina za liječenje akutne infekcije i visoko učinkovitog cjepiva protiv toksoida.
Iako je imunizacija toksoidom učinila difteriju rijetkom bolešću u područjima gdje standardi javnog zdravstva zahtijevaju cijepljenje, izbijanja difterije i dalje se javljaju u necijepljenim i imunokompromitiranim skupinama. Nasuprot tome, široko rasprostranjene epidemije difterije koje su dosegle epidemijske razmjere dogodile su se u područjima gdje su aktivni programi imunizacije obustavljeni.
Druge vrste korinebakterija
Uz C. diphtheriae, C. ulcerans i C. pseudotuberculosis, C. pseudodiphtheriticum i C. xerosis mogu povremeno uzrokovati infekcije nazofarinksa i kože. Posljednja dva soja prepoznatljiva su po svojoj sposobnosti proizvodnje pirazinamidaze. U veterinarskoj medicini, C. renale i C. kutscheri važni su patogeni koji uzrokuju pijelonefritis kod goveda, odnosno latentne infekcije kod miševa.
Uzroci
Uzročnik difterije, Corynebacterium diphtheriae, je tanka, blago zakrivljena šipka s paukolikim zadebljanjima na krajevima, nepomična; ne stvara spore, kapsule ili flagele i gram-pozitivna je.
Osim toksina, korinebakterije difterije tijekom svojih životnih procesa proizvode neuraminidazu, hijaluronidazu, hemolizin, nekrotizirajuće i difuzne faktore, koji mogu uzrokovati nekrozu i ukapljivanje glavne tvari vezivnog tkiva.
Na temelju sposobnosti stvaranja toksina, korinebakterije difterije dijele se na toksigene i netoksigene.
Difterijski toksin je snažan bakterijski egzotoksin koji određuje i opće i lokalne kliničke manifestacije bolesti. Toksigenost je genetski određena. Netoksigene korinebakterije difterije ne uzrokuju bolest.
Prema kulturnim i morfološkim značajkama, sve korinebakterije difterije podijeljene su u 3 varijante: gravis, mitis, intermedius. Ne postoji izravna ovisnost težine bolesti o varijanti korinebakterija difterije. Svaka varijanta sadrži i toksigene i netoksigene sojeve. Toksigene korinebakterije svih varijanti proizvode identičan toksin. [ 1 ]
Struktura, klasifikacija i vrste antigena
Corynebacterium diphtheriae je gram-pozitivna, nepokretna bakterija u obliku palice. Sojevi koji rastu u tkivu ili starije in vitro kulture sadrže fine mrlje u staničnim stijenkama koje omogućuju promjenu boje tijekom Gram bojenja i rezultiraju varijabilnom Gramovom reakcijom. Starije kulture često sadrže metakromatske granule (polimetafosfat) koje se boje plavkasto-ljubičasto metilenskim plavilom. Šećeri stanične stijenke uključuju arabinozu, galaktozu i manozu. Osim toga, može se izolirati toksični 6,6'-ester trehaloze, koji sadrži korinemikolne i korinemikolenske kiseline u ekvimolarnim koncentracijama. Prepoznaju se tri različita tipa kulture: mitis, intermedius, gravis.
Većini sojeva potrebne su nikotinska i pantotenska kiselina za rast; nekima su potrebni i tiamin, biotin ili pimelična kiselina. Za optimalnu proizvodnju difterijskog toksina, medij se mora obogatiti aminokiselinama i mora se ostaviti sa strane.
Već 1887. godine Loeffler je opisao izolaciju avirulentnog (netoksigenog) C. diphtheriae koji se nije mogao razlikovati od virulentnih (toksigenih) sojeva izoliranih od pacijenata kod zdravih osoba. Sada je prepoznato da se avirulentni sojevi C. diphtheriae mogu pretvoriti u virulentni fenotip nakon infekcije i lizogenizacije jednim od brojnih različitih korinebakteriofaga koji nose strukturni gen za difterijski toksin, tox. Lizogena konverzija avirulentnog u virulentni fenotip može se dogoditi i in situ i in vitro. Strukturni gen za difterijski toksin nije esencijalan ni za korinebakteriofag ni za C. diphtheriae. Unatoč ovom zapažanju, genetski drift difterijskog toksina nije uočen.
Patogeneza
Ulazna mjesta infekcije su sluznice orofarinksa, nosa, grkljana, rjeđe sluznica očiju i genitalija, kao i oštećena koža, rane ili opekline, pelenski osip, nezacijeljena pupčana rana. Na ulaznom mjestu difterijski korinebakterij se razmnožava i luči egzotoksin.
Eksudat bogat fibrinogenom se izlučuje i pretvara u fibrin pod utjecajem trombokinaze koja se oslobađa tijekom nekroze epitelnih stanica. Nastaje fibrinski film - karakterističan znak difterije.
Asimptomatsko nazofaringealno nosioštvo uobičajeno je u endemskim područjima difterije. Kod osjetljivih osoba, toksigeni sojevi uzrokuju bolest replikacijom i izlučivanjem difterijskog toksina u nazofarinksu ili kožnim lezijama. Difterijska lezija često je prekrivena pseudomembranom sastavljenom od fibrina, bakterija i upalnih stanica. Difterijski toksin može se proteolitički cijepati na dva fragmenta: N-terminalni fragment A (katalitička domena) i fragment B (transmembranska i receptor-vezujuća domena). Fragment A katalizira NAD+-ovisnu ADP-ribozilaciju elongacijskog faktora 2, čime inhibira sintezu proteina u eukariotskim stanicama. Fragment B veže se na receptor na površini stanice i olakšava dostavu fragmenta A u citosol.
Zaštitni imunitet uključuje odgovor antitijela na difterijski toksin nakon kliničke bolesti ili na difterijski toksin (toksin inaktiviran formaldehidom) nakon imunizacije.
Kolonizacija
Malo se zna o čimbenicima koji posreduju u kolonizaciji C. diphtheriae. Međutim, jasno je da čimbenici osim proizvodnje difterijskog toksina doprinose virulenciji. Epidemiološke studije pokazale su da određeni lizotip može perzistirati u populaciji dulje vrijeme. Kasnije ga može zamijeniti drugi lizotip. Pojava i naknadna dominacija novog lizotipa u populaciji vjerojatno je povezana s njegovom sposobnošću kolonizacije i učinkovitog natjecanja u svom segmentu nazofaringealne ekološke niše. Corynebacterium diphtheriae može proizvoditi neuraminidazu, koja cijepa sijalinsku kiselinu na površini stanica na njezine komponente piruvat i N-acetilneuraminsku kiselinu. Vrpcasti faktor (6,6'-di-O-mikoloil-α, α'-D-trehaloza) je površinska komponenta C. diphtheriae, ali njegova uloga u kolonizaciji ljudskog domaćina nije jasna.
Proizvodnja toksina difterije
Strukturni gen difterijskog toksina, tox, pripada obitelji blisko srodnih korinebakteriofaga, od kojih je β-fag najbolje proučen. Regulacija ekspresije difterijskog toksina posredovana je represorom aktiviranim željezom, DtxR, koji je kodiran genomom C. diphtheriae. Ekspresija toksina ovisi o fiziološkom stanju C. diphtheriae. U uvjetima u kojima željezo postaje supstrat koji ograničava brzinu rasta, željezo se disocira od DtxR, gen toksikodendron se aktivira, a difterijski toksin se sintetizira i izlučuje u medij za uzgoj maksimalnim brzinama.
Difterijski toksin je neobično jak; za osjetljive vrste (npr. ljude, majmune, zečeve, zamorce) čak 100 do 150 ng/kg tjelesne težine je smrtonosno. Difterijski toksin sastoji se od jednog polipeptidnog lanca od 535 aminokiselina. Biokemijska, genetska i rendgenska strukturna analiza pokazuju da se toksin sastoji od tri strukturne/funkcionalne domene:
- N-terminalna ADP-riboziltransferaza (katalitička domena);
- regija koja olakšava dostavu katalitičke domene kroz staničnu membranu (transmembranska domena);
- domena vezanja receptora eukariotskih stanica.
Nakon blage digestije tripsinom i redukcije u denaturirajućim uvjetima, difterijski toksin može se specifično cijepati na svojoj proteazno-osjetljivoj petlji u dva polipeptidna fragmenta (A i B). Fragment A je N-terminalna komponenta toksina od 21 kDa i sadrži katalitičko mjesto za ADP-ribozilaciju elongacijskog faktora 2 (EF-2).
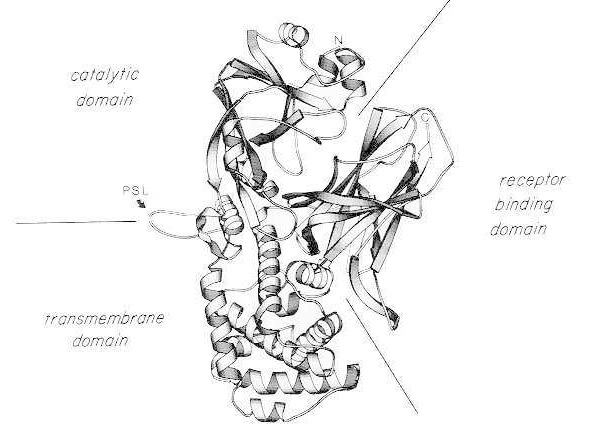
Vrpčasti dijagram rendgenske kristalne strukture monomernog nativnog difterijskog toksina. (modificirano iz Bennett MJ, Choe S, Eisenberg D: Zamjena domena: Isprepleteni savezi između proteina. Proc Natl Acad Sci, SAD, 91: 3127, 1994). Prikazani su relativni položaji katalitičkih, transmembranskih i domena koje vežu receptore. Netaknuti toksin mogu se cijepati tripsin-sličnim proteazama na Arg190, Arg192 i/ili Arg193, koje se nalaze u petlji osjetljivoj na proteaze (PSL). Nakon redukcije disulfidnog mosta između Cys186 i Cys201, toksin se može razdvojiti na A i B fragmente. Prikazani su amino-terminalni (N) i karboksi-terminalni (C) terminalni (C) toksina. Trakasti dijagram izrađen je pomoću programa MOLESCRIPT.
C-terminalni fragment, fragment B, nosi transmembranske i receptorske domene toksina.
Trovanje jedne eukariotske stanice difterijskim toksinom uključuje najmanje četiri različita koraka:
- vezanje toksina za njegov receptor na površini stanice;
- grupiranje nabijenih receptora u obložene jamice i internalizacija toksina putem endocitoze posredovane receptorima; nakon zakiseljavanja endocitne vezikule membranski povezanom protonskom pumpom pokretanom ATP-om,
- umetanje transmembranske domene u membranu i olakšana isporuka katalitičke domene u citosol, i
- ADP-ribozilacija EF-2, što rezultira nepovratnom supresijom sinteze proteina.
Pokazalo se da je jedna molekula katalitičke domene dostavljena u citosol dovoljna da bude smrtonosna za stanicu.
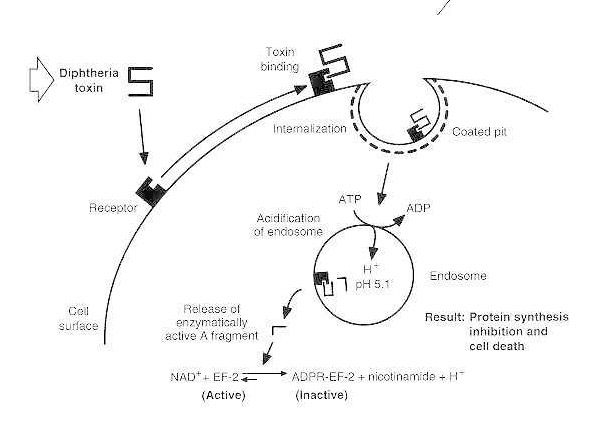
Shematski dijagram intoksikacije difterijom osjetljive eukariotske stanice.
Toksin se veže za receptor na površini stanice i internalizira se putem endocitoze posredovane receptorom; nakon zakiseljavanja endosoma, transmembranska domena se ubacuje u membranu vezikula; katalitička domena se dostavlja u citosol, što dovodi do inhibicije sinteze proteina i stanične smrti.
Epidemiologija
Prije masovne imunizacije stanovništva SAD-a toksoidom difterije, difterija je obično bila dječja bolest. Značajan aspekt masovne imunizacije toksoidom difterije jest da se s porastom postotka populacije sa zaštitnim razinama imuniteta na antitoksine (≥ 0,01 IU/mL) smanjuje učestalost izolacije toksigenih sojeva iz populacije. Danas je u Sjedinjenim Državama, gdje je klinička difterija gotovo potpuno nestala, izolacija toksigenih sojeva C. diphtheriae rijetka. Budući da subklinička infekcija više ne pruža izvor izloženosti antigenu difterije i, osim ako se ne pojača, imunitet na antitoksine opada, veliki postotak odraslih (30 do 60%) ima razine antitoksina ispod zaštitnih razina i u opasnosti je. U Sjedinjenim Državama, Europi i Istočnoj Europi, nedavne epidemije difterije dogodile su se prvenstveno među osobama koje zlouporabljaju alkohol i/ili droge. Unutar ove skupine, nositelji toksigenog C. diphtheriae imaju umjereno visoku razinu imuniteta na antitoksine. Nedavni slom mjera javnog zdravstva u Rusiji rezultirao je epidemijom difterije. Do kraja 1994. u Rusiji je zabilježeno više od 80 000 slučajeva i više od 2 000 smrtnih slučajeva.
Žarišne epidemije difterije gotovo su uvijek povezane s imunološkim nositeljem koji se vratio iz regije gdje je difterija endemska. Doista, nedavne epidemije kliničke difterije u Sjedinjenim Državama i Europi povezane su s putnicima koji se vraćaju iz Rusije i istočne Europe. Toksigeni sojevi C. diphtheriae prenose se izravno s osobe na osobu kapljicama u zraku. Poznato je da toksigeni sojevi mogu izravno kolonizirati nazofaringealnu šupljinu. Osim toga, toksigeni gen može se širiti neizravno oslobađanjem toksigenog korinebakteriofaga i lizogenom transformacijom netoksigenog autohtonog C. diphtheriae in situ. [ 5 ]
Osim određivanja biotipa i lizotipa izolata C. diphtheriae, tehnike molekularne biologije sada se mogu koristiti za proučavanje epidemija difterije. Obrasci digestije kromosomske DNA C. diphtheriae restrikcijskim endonukleazama korišteni su za proučavanje kliničkih epidemija, kao i upotreba kloniranih korinebakterijskih insercijskih sekvenci kao genetske probe.
Schickov test se već dugi niz godina koristi za procjenu imuniteta na difterijski toksin, iako je sada u mnogim područjima zamijenjen serološkim testom za specifična antitijela na difterijski toksin. U Schickovom testu, mala količina difterijskog toksina (približno 0,8 ng u 0,2 ml) ubrizgava se intradermalno u podlakticu (mjesto testiranja), a 0,0124 μg difterijskog toksina u 0,2 ml ubrizgava se intradermalno u kontrolno mjesto. Očitavanja se provode nakon 48 i 96 sati. Nespecifične kožne reakcije obično dosežu vrhunac nakon 48 sati. Nakon 96 sati, eritematozna reakcija s mogućom nekrozom na mjestu testiranja ukazuje na nedovoljan antitoksični imunitet za neutralizaciju toksina (≤ 0,03 IU/ml). Upala i u testnom i u kontrolnom području nakon 48 sati ukazuje na reakciju preosjetljivosti na antigenski pripravak.
Obrasci
Corynebacterium diphtheriae inficira nazofarinks ili kožu. Toksigeni sojevi proizvode snažan egzotoksin koji može uzrokovati difteriju. Simptomi difterije uključuju faringitis, vrućicu i oticanje vrata ili područja oko kožne lezije. Difterične lezije prekrivene su pseudomembranom. Toksin se širi krvotokom do udaljenih organa i može uzrokovati paralizu i kongestivno zatajenje srca. [ 6 ]
Postoje dvije vrste kliničke difterije: nazofaringealna i kožna. Simptomi faringealne difterije kreću se od blagog faringitisa do hipoksije zbog opstrukcije dišnih putova pseudomembranom. Zahvaćenost cervikalnih limfnih čvorova može uzrokovati ozbiljno oticanje vrata (difterija bikovog vrata), a pacijent može razviti vrućicu (≥ 38°C). Kožne lezije kod kožne difterije obično su prekrivene sivo-smeđom pseudomembranom. Kao posljedica djelovanja toksina difterije na periferne motorne neurone i miokard mogu se razviti životno opasne sistemske komplikacije, uglavnom gubitak motoričke funkcije (npr. otežano gutanje) i kongestivno zatajenje srca.
Kontrolirati
Kontrola difterije ovisi o adekvatnoj imunizaciji difterijskim toksoidom: difterijski toksin inaktiviran formaldehidom, koji ostaje antigenski netaknut. Toksoid se priprema inkubacijom difterijskog toksina s formaldehidom na 37°C u alkalnim uvjetima. Imunizacija protiv difterije trebala bi započeti u drugom mjesecu života nizom od tri primarne doze u intervalima od 4 do 8 tjedana, nakon čega slijedi četvrta doza otprilike 1 godinu nakon posljednje primarne. Difterijski toksoid se široko koristi kao komponenta cjepiva protiv difterije, hripavca i tetanusa (DPT). Epidemiološke studije pokazale su da je imunizacija protiv difterije približno 97% učinkovita. Iako se masovna imunizacija protiv difterije provodi u Sjedinjenim Državama i Europi, a stope cijepljenja djece su adekvatne, veliki dio odrasle populacije može imati titre antitijela ispod zaštitnih razina. Odrasle treba revakcinirati difterijskim toksoidom svakih 10 godina. Doista, docjepljivanje toksoidom difterije i tetanusa trebalo bi dati putnicima u područja s visokim stopama endemske difterije (Srednja i Južna Amerika, Afrika, Azija, Rusija i Istočna Europa). Posljednjih godina, upotreba visoko pročišćenih toksoidnih pripravaka za imunizaciju smanjila je povremene teške reakcije preosjetljivosti. docjepljivanje toksoidom difterije i tetanusa trebalo bi dati putnicima u područja s visokim stopama endemske difterije (Srednja i Južna Amerika, Afrika, Azija, Rusija i Istočna Europa). Posljednjih godina, upotreba visoko pročišćenih toksoidnih pripravaka za imunizaciju smanjila je povremene teške reakcije preosjetljivosti. Docjepljivanje toksoidom difterije i tetanusa trebalo bi dati putnicima u područja s visokim stopama endemske difterije (Srednja i Južna Amerika, Afrika, Azija, Rusija i Istočna Europa). Posljednjih godina, upotreba visoko pročišćenih toksoidnih pripravaka za imunizaciju smanjila je povremene teške reakcije preosjetljivosti.
Iako se antibiotici (poput penicilina i eritromicina) koriste kao dio liječenja pacijenata s difterijom, brza pasivna imunizacija difterijskim antitoksinom najučinkovitija je u smanjenju smrtnosti. Dugi poluživot specifičnog antitoksina u krvotoku važan je čimbenik u osiguravanju učinkovite neutralizacije difterijskog toksina; međutim, da bi bio učinkovit, antitoksin mora reagirati s toksinom prije nego što može ući u stanicu.
Reinženjering difterijskog toksina za razvoj citotoksina specifičnih za eukariotske receptore
Proteinski inženjering je novo i brzo razvijajuće područje molekularne biologije; kombinira metodologije rekombinantne DNA i sintezu DNA u čvrstoj fazi kako bi se dizajnirali i konstruirali himerni geni čiji produkti imaju jedinstvena svojstva. Studije odnosa strukture i funkcije difterijskog toksina jasno su pokazale da je ovaj toksin protein s tri domene: katalitičkom, transmembranskom i receptorskom. Bilo je moguće genetski zamijeniti nativnu domenu difterijskog toksina koja veže receptor raznim polipeptidnim hormonima i citokinima (npr. α-melanocit-stimulirajući hormon [α-MSH], interleukin (IL) 2, IL-4, IL-6, IL-7, epidermalni faktor rasta). Rezultirajući himerni proteini ili fuzijski toksini kombiniraju specifičnost vezanja citokina za receptor s transmembranskom i katalitičkom domenom toksina. U svakom slučaju, pokazalo se da fuzijski toksini selektivno truju samo one stanice koje nose odgovarajući ciljni receptor. Prvi od ovih genetski modificiranih fuzijskih toksina, DAB 389IL-2, trenutno se procjenjuje u kliničkim ispitivanjima na ljudima za liječenje refraktornih limfoma i autoimunih bolesti u kojima stanice s visokim afinitetom IL-2 receptora igraju važnu ulogu u patogenezi.[ 7 ] Pokazalo se da je primjena DAB 389 IL-2 sigurna, dobro podnošljiva i sposobna izazvati trajnu remisiju bolesti bez ozbiljnih nuspojava. Vjerojatno je da će fuzijski toksini na bazi difterijskog toksina postati važni novi biološki agensi za liječenje specifičnih tumora ili bolesti u kojima se mogu ciljati specifični receptori na površini stanica.


 [
[