Medicinski stručnjak članka
Nove publikacije
Bjesnoća kod djece
Posljednji pregledao: 04.07.2025

Svi iLive sadržaji medicinski se pregledavaju ili provjeravaju kako bi se osigurala što je moguće točnija činjenica.
Imamo stroge smjernice za pronalaženje izvora i samo povezujemo s uglednim medijskim stranicama, akademskim istraživačkim institucijama i, kad god je to moguće, medicinski pregledanim studijama. Imajte na umu da su brojevi u zagradama ([1], [2], itd.) Poveznice koje se mogu kliknuti na ove studije.
Ako smatrate da je bilo koji od naših sadržaja netočan, zastario ili na neki drugi način upitan, odaberite ga i pritisnite Ctrl + Enter.
Bjesnoća, ili hidrofobija, je akutna virusna bolest koja se prenosi ugrizom zaražene životinje, s oštećenjem živčanog sustava i razvojem teškog encefalitisa sa smrtnim ishodom.
Epidemiologija
Virus bjesnoće, pošast javnog zdravstva od davnina, trenutno uzrokuje otprilike 59 000 ljudskih smrti svake godine, a gotovo sve se prenose ugrizima pasa. To ima značajan ekonomski utjecaj na zemlje u razvoju, posebno u Africi i Aziji, koje mogu podnijeti najmanje takvih gubitaka. Međutim, unatoč gotovo 100%-tnoj stopi smrtnosti, bjesnoća kod pasa je u potpunosti sprječljiva bolest, a povijesni primjeri iskorjenjivanja bjesnoće kod pasa u razvijenom svijetu to potvrđuju. [ 1 ]
Uzroci bjesnoća
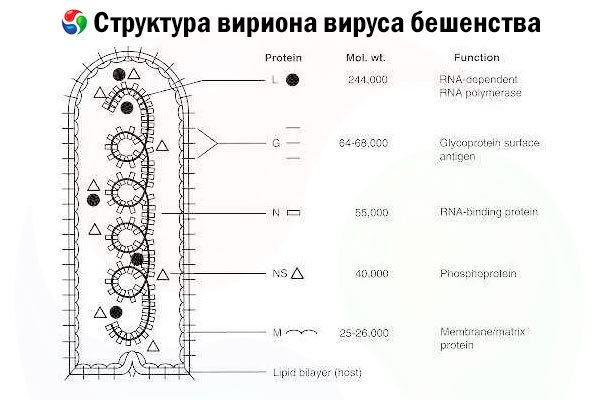
Uzročnik je virus bjesnoće (RV), virus s negativnim lancem RNA iz porodice rabdovirusa, veličine približno 60 nm × 180 nm.
Sastoji se od unutarnje proteinske jezgre, ili nukleokapside, koja sadrži nukleinsku kiselinu, i vanjske membrane, dvosloja koji sadrži lipide i prekriven je transmembranskim glikoproteinskim šiljcima. Ima relativno jednostavnu modularnu strukturu genoma i kodira pet strukturnih proteina:
- RNA-ovisna RNA polimeraza (L),
- nukleoprotein (N),
- fosforilirani protein (P),
- matrični protein (M) i
- glikoprotein vanjske površine (G).
N, P i L proteini zajedno s genomskom RNA tvore ribonukleoproteinski kompleks. G je jedini RV antigen sposoban inducirati proizvodnju RV neutralizirajućih antitijela, koja su glavni imunološki efektori protiv letalne RV infekcije. S druge strane, pokazalo se da je ribonukleoproteinski kompleks glavni RV antigen sposoban inducirati CD4+ T stanice, što može pojačati proizvodnju RV neutralizirajućih antitijela putem intrastrukturnog prepoznavanja antigena.[ 2 ] Ribonukleoproteinski kompleks može igrati važnu ulogu u uspostavljanju imunološke memorije i dugoročnog imuniteta.[ 3 ]
Klasifikacija i vrste antigena
Rod Lyssavirus uključuje virus bjesnoće i antigenski i genetski srodne viruse bjesnoće: Lagos, Mokola i Duvenhage viruse šišmiša, kao i dva pretpostavljena podtipa europskih lisavirusa šišmiša. Studije unakrsne zaštite pokazuju da životinje imunizirane tradicionalnim cjepivima protiv bjesnoće možda neće biti u potpunosti zaštićene kada se izlože drugim lisavirusima.
Virusi bjesnoće mogu se klasificirati kao fiksni (adaptirani pasažom u životinjama ili staničnoj kulturi) ili ulični (divlji tip). Korištenje monoklonskih antitijela i genetskog sekvenciranja za razlikovanje uličnih virusa bjesnoće pomoglo je u identificiranju virusnih varijanti koje potječu iz glavnih rezervoara domaćina diljem svijeta i u sugeriranju vjerojatnih izvora izloženosti ljudi kada u pacijentovom slučaju nije bilo podataka o ugrizu životinje.[ 8 ]
Patogeneza
Glavni rezervoar i izvor zaraze među divljim životinjama su vukovi, lisice, šakali, šišmiši, a među domaćim životinjama - psi i mačke, rijetko - konji, goveda, svinje, štakori itd. Prijenos zaraze s osobe na osobu, iako je moguć, izuzetno je rijedak. Ovo je tipična zoonotska infekcija. Ljudi se zaraze bjesnoćom uglavnom od pasa.
Nakon što čovjeka ugrize bolesna životinja, virus se razmnožava u mišićnom tkivu na mjestu ugriza, a zatim, došavši do završetaka perifernih senzornih živaca, širi se centripetalno, dosežući motorne neurone. Vrijeme potrebno za kretanje virusa i zahvaćanje mozga ovisi o mjestu ugriza. U slučaju teških ugriza glave i lica, virus može doseći središnji živčani sustav za 15-20 dana, a u slučaju manjih oštećenja kože trupa i udova te posljedično male doze patogena, proces premještanja virusa u središnji živčani sustav može se odgoditi za nekoliko mjeseci ili čak i do 1-1,5 godina. Nakon što dospije u središnji živčani sustav, virus se fiksira u tkivima mozga i leđne moždine, uglavnom u neuronima produžene moždine, Ammonovog roga i baze mozga. U leđnoj moždini najviše su zahvaćeni stražnji rogovi. Iz središnjeg živčanog sustava virus centrifugalno duž živčanih debla dospijeva do slinovnica, gdje se razmnožava i izlučuje slinom.
Koncepti u patogenezi bjesnoće
RV ima širok raspon domaćina i može zaraziti gotovo sve sisavce. Iako je zabilježeno nekoliko putova prijenosa RV-a, prirodna infekcija najčešće se događa ugrizom. Osim ugriza, konzumacija lešina zaraženih RV-om može potaknuti infekciju virusom bjesnoće kod arktičkih lisica, a kontakt RV-a sa sluznicama utvrđen je kao još jedan mogući put prijenosa.[ 9 ] U nekim neuobičajenim okolnostima, poput slučajnog ispuštanja RV-a kao aerosola u laboratoriju ili RV-a kao aerosola u špiljama u kojima obitava veliki broj šišmiša,[ 10 ] može doći do prijenosa aerosola.
Još nije jasno repliciraju li se sojevi uličnog RV-a i sojevi RV-a prilagođeni miševima ili sojevi RV-a prilagođeni kulturi tkiva na mjestu inokulacije prije nego što uđu u središnji živčani sustav. Dok je eksperimentalna intramuskularna infekcija mladih hrčaka ili rakuna uličnim RV-om otkrila replikaciju RV-a u stanicama poprečno-prugastih mišića prije nego što je virus napao aksone motornih neurona preko neuromuskularnih spojeva,[ 11 ],[ 12 ] intramuskularna infekcija miševa s mišjem prilagođenim CVS-24 RV-om pokazala je da RV migrira izravno u središnji živčani sustav bez prethodne replikacije na mjestu inokulacije.[ 13 ] Jednom kada se nađe u završecima nemijeliniziranih aksona, RV se retrogradno transportira u tijelo stanice.
Nedavna otkrića ukazuju na to da bi transport aksonskih vezikula mogao predstavljati ključnu strategiju za kretanje viriona na velike udaljenosti u aksonima.[ 14 ] Procijenjeno je da RV migrira unutar aksona brzinom od 3 mm/h.[ 15 ] Infekcija se zatim širi kroz lanac neurona povezanih sinaptičkim spojevima. Međutim, točan mehanizam koji potiče transsinaptičko širenje još uvijek nije poznat. Nakon infekcije mozga, virus se centrifugalno širi u periferni i autonomni živčani sustav u mnogim perifernim organima.[ 16 ] U posljednjoj fazi ciklusa infekcije, RV migrira u slinovnice; nakon replikacije u mukogenim acinarnim stanicama, oslobađa se u slinu i spreman je za prijenos na sljedećeg domaćina.[ 17 ]
Što se tiče patologije izazvane virusom bjesnoće, apoptotička stanična smrt predložena je kao potencijalni patogeni mehanizam u eksperimentalnim modelima bjesnoće miševa zaraženih fiksnim sojem RV-a.[ 18 ] Patogeni mehanizam koji može doprinijeti dubokoj disfunkciji CNS-a karakterističnoj za bjesnoću može biti oštećena neuronska funkcija. Pokazalo se da je ekspresija gena značajno smanjena u neuronima zaraženim RV-om, što rezultira općim supresijom sinteze proteina,[ 19 ] a nekoliko studija pokazalo je oštećenu neurotransmisiju nakon RV infekcije. Jiang je pokazao da je vezanje antagonista acetilkolinskog receptora na zaražene homogenate mozga štakora smanjeno u usporedbi s kontrolama.[ 20 ] Oštećeno oslobađanje i vezanje serotonina, neurotransmitera uključenog u kontrolu ciklusa spavanja, percepcije boli i ponašanja, također je uočeno u mozgu štakora zaraženog RV-om. [ 21 ], [ 22 ] Osim što utječe na neurotransmisiju, infekcija desne klijetke može utjecati i na ionske kanale. Zaražene stanice mišjeg neuroblastoma pokazuju smanjenu funkcionalnu ekspresiju naponski reguliranih natrijevih kanala, što može spriječiti akcijske potencijale i u konačnici dovesti do funkcionalnog oštećenja. [ 23 ]
Osim odsutnosti ozbiljnih patoloških lezija u središnjem živčanom sustavu, većina slučajeva bjesnoće kod ljudi ne izaziva imunološki odgovor 7 do 10 dana nakon pojave kliničkih znakova. Ove duboke razlike između patogeneze bjesnoće i patogeneze većine drugih virusnih ili bakterijskih infekcija središnjeg živčanog sustava dodatno podupire činjenica da je imunosupresija ili neučinkovita ili štetna za ishod bjesnoće.[ 24 ] Niska razina imunološkog odgovora koja se često opaža kod žrtava bjesnoće zbunjujuća je jer se ne može objasniti slabom imunogenošću antigena RV-a. Zapravo, RV G i nukleokapsidni protein su potentni antigeni B- i T-stanica kada se primjenjuju parenteralno.[ 25 ] Moguće objašnjenje za nizak stupanj imunološkog odgovora protiv RV-a kod ljudi ili životinja s bjesnoćom može biti da RV infekcija središnjeg živčanog sustava uzrokuje imunosupresiju,[ 26 ] te je predloženo da RV koristi subverzivnu strategiju koja uključuje sprječavanje apoptoze i uništavanje invazivnih T stanica.[ 27 ]
Atenuirani sojevi RV-a koji su prilagođeni stanicama koje nisu neuronske značajno se razlikuju od patogenih sojeva uličnog RV-a po svojoj neuroinvazivnosti, što se odnosi na njihovu sposobnost invazije CNS-a s perifernih mjesta. U tom smislu, sojevi RV-a prilagođeni kulturi tkiva ili nemaju ili imaju samo ograničenu sposobnost invazije CNS-a s perifernih mjesta, dok su sojevi uličnog RV-a ili sojevi RV-a prilagođeni miševima poput CVS-24 vrlo invazivni.[ 28 ] Ključni čimbenici uključeni u neuroinvaziju RV-a uključuju unos virusa, aksonski transport, transsinaptičko širenje i brzinu replikacije virusa.
Do nedavno, naše znanje o patogenezi RV-a bilo je ograničeno i temeljilo se prvenstveno na deskriptivnim studijama sojeva RV-a s ulice ili eksperimentalnim infekcijama s atenuiranim sojevima prilagođenim u laboratoriju. Pojava tehnologije reverzne genetike omogućila nam je identifikaciju virusnih elemenata koji određuju patogeni fenotip RV-a i bolje razumijevanje mehanizama uključenih u patogenezu bjesnoće.
Identifikacija virusnih elemenata koji kontroliraju akviziciju, širenje i replikaciju virusa bjesnoće
- Virusni elementi uključeni u hvatanje virusa
Infekcija RV-om započinje vezanjem virusa na pretpostavljeni stanični receptor. Iako je nekoliko molekula na površini membrane predloženo kao RV receptori, uključujući nikotinski acetilkolinski receptor,[ 29 ] molekulu adhezije neuronskih stanica[ 30 ] i neurotrofinski receptor niskog afiniteta p75 NTR,[ 31 ] još uvijek nije jasno igraju li te molekule zapravo ulogu u životnom ciklusu virusa bjesnoće. U tom kontekstu, nedavno je pokazano da interakcija RV G-p75 NTR nije potrebna za RV infekciju primarnih neurona.[ 32 ] Nakon vezanja receptora, RV se internalizira putem adsorptivne ili receptorom posredovane endocitoze.[ 33 ] Okruženje s niskim pH unutar endosomskog odjeljka zatim inducira konformacijske promjene u RV G koje pokreću fuziju virusne membrane s endosomskom membranom, čime se oslobađa RNP u citoplazmu.[ 34 ] Kod virusa, RV G igra ključnu ulogu u virusnom unosu, najvjerojatnije putem interakcija s pretpostavljenim staničnim receptorima koji olakšavaju brzi unos. U tom smislu, dokazano je da patogenost sojeva RV prilagođenih kulturi tkiva (npr. ERA, HEP i CVS-11) korelira s prisutnošću determinante smještene na antigenskom mjestu III G proteina. [ 35 ] Mutacija Arg → Gln na položaju 333 u ovom antigenskom mjestu ERA G proteina rezultirala je sedmerostrukim odgađanjem internalizacije varijante Gln333 RV u usporedbi s varijantom divljeg tipa. Mutacija Asn194→Lys194 u RV G, koja objašnjava ponovnu pojavu patogenog fenotipa, bila je povezana sa značajnim smanjenjem vremena internalizacije.[ 36 ] Nadalje, eksperimenti s himernim RV-ima pokazali su da je vrijeme potrebno za internalizaciju RV viriona značajno povećano, a patogenost snažno smanjena nakon zamjene G gena visoko patogenog soja SB RV, koji je izveden iz cDNA klona soja RV-18 povezanog sa šišmišima izvedenog iz srebra,[ 37 ] s genom visoko atenuiranog soja SN, koji je izoliran iz cDNA klona cjepiva protiv RV SAD B19.[ 38 ] Zajedno, ovi podaci podupiru ideju da je kinetika unosa virusa, koja je funkcija RV G, glavna odrednica patogenosti RV.
- Virusni elementi uključeni u širenje i prijenos virusa
Jedinstveno svojstvo virusa bjesnoće je njegova sposobnost širenja iz stanice u stanicu. Opažanje da varijanta Gln333 ERA gubi pH-ovisnu aktivnost stanične fuzije in vitro [ 39 ] i pokazuje znatno smanjenu sposobnost širenja iz stanice u stanicu [ 40 ] sugerira da RV G također igra ključnu ulogu u širenju iz stanice u stanicu i stoga prijenosu virusa, vjerojatno putem svoje fuziogene aktivnosti. Ovu mogućnost dodatno podupire nalaz da je brzina širenja patogenog RV revertanta SPBNGAK gotovo dvostruko veća od one određene za nepatogenu varijantu SPBNGA. Zanimljivo je da je mutacija Asn 194 → Lys 194 u G SPBNGAK uzrokovala pomicanje pH praga za membransku fuziju na viši pH, što podupire hipotezu da je viši pH prag za membransku fuziju povezan s povećanim širenjem virusa. [ 41 ]
Studije transneuronalnih indikatora RV infekcije kod štakora [ 42 ] i rezus majmuna [ 43 ] pokazale su da virus bjesnoće migrira isključivo u retrogradnom smjeru u aksonima. Iako je nekoliko RV proteina uključeno u mehanizme neuronskog transporta, čini se da RV G igra predominantnu ulogu u transneuronalnom širenju RV infekcije. Na primjer, dok periferna infekcija virusom zarazne anemije konja (EIAV) pseudotipiziran s RV G rezultira prijenosom virusa u leđnu moždinu, isti EIAV pseudotipiziran s virusom vezikularnog stomatitisa G nije uspio ući u živčani sustav. [ 44 ] Nadalje, utvrđeno je da je širenje virusa mutanta ERA G Arg 333 → Gln 333 u CNS-u snažno smanjeno u usporedbi s mutantom divljeg tipa, što dodatno sugerira funkciju intaktnog RV G u transsinaptičkom širenju. Međutim, najuvjerljiviji dokaz za važnu ulogu RV G u transsinaptičkom transportu dolazi od intrakranijalne infekcije miševa rekombinantnim G-deficitnim RV virusom, što je pokazalo da je infekcija ostala ograničena na neurone na mjestu inokulacije bez ikakvih dokaza o širenju na sekundarne neurone.[ 45 ] Međutim, vjerojatno je da osim RV G, RV M također igra ulogu u širenju virusa, a time i u transsinaptičkom transportu. U tom smislu, pokazano je da je širenje himerne SN-BMBG RV varijante, koja sadrži i M i G iz visoko patogenog SB, bilo značajno veće od širenja himerne SN-BG ili SN-BM varijante, koje sadrže G i M iz SB, što sugerira da optimalna interakcija M s G može igrati važnu ulogu u širenju virusa od stanice do stanice. [ 46 ] Budući da RV M podržava pupanje virusa, [ 47 ] vjerojatno je da je učinkovitije širenje himerne varijante RV SN-BMBG posljedica optimalnog pupanja virusa na postsinaptičkoj membrani.
Nedavne studije pokazale su da interakcija između RV P i lakog lanca dineina povezuje RV RNP s transportnim sustavom stanice domaćina, čime se olakšava retrogradni aksonski transport virusa.[ 48 ],[ 49 ] Međutim, periferna infekcija odraslih miševa pokazala je da delecija LC8 vezne domene RV P ne sprječava ulazak virusa u CNS, što sugerira da RV protein nije izravno uključen u retrogradno aksonsko širenje RV.[ 50 ]
- Virusni elementi koji kontroliraju replikaciju virusa
Za razliku od mnogih drugih virusa, poput virusa influence, patogenost RV obrnuto je proporcionalna brzini sinteze virusne RNA i produkciji zaraznih virusnih čestica. Usporedba razina virusne mRNA i genomske RNA koju proizvode različiti himerni virusi sugerira da su transkripcija i replikacija virusne RNA regulirane višestrukim čimbenicima, uključujući RV M, koji je identificiran kao trans-djelujući faktor koji posreduje prijelaz s početnih visokih razina sinteze mRNA na sintezu genomske RNA.[ 51 ] Nadalje, M iz svih rabdovirusa može isključiti ekspresiju virusnih gena vezanjem na RNP, što rezultira stvaranjem visoko kondenzirane strukture slične glavnoj strukturi koja nije u stanju podržati sintezu RNA.
Kako bi se identificirali drugi virusni elementi koji kontroliraju patogenost reguliranjem virusne replikacije, 5' terminalne sekvence visoko patogenog soja SB postupno su zamijenjene sekvencama iz visoko atenuiranog cjepivnog soja SN, što je rezultiralo rekombinantnim virusima SB2 (terminalna sekvenca [TS] + L), SB3 (TS + L + pseudogen [Ψ]), SB4 (TS + L + Ψ + G) i SB5 (TS + L + Ψ + G + M). Intramuskularna infekcija roditeljskim SB i SN virusima te himernim RV-ima SB2, SB3, SB4 i SB5 izazvala je najviše stope smrtnosti kod miševa zaraženih SB-om, a nije bilo morbiditeta ili smrtnosti kod miševa zaraženih SN-om. Zamjena TS, L i SB odgovarajućim elementima iz SN rezultirala je umjerenim smanjenjem morbiditeta i smrtnosti, a dodatna zamjena G ili G plus M snažno je smanjila ili potpuno ukinula virusnu patogenost.
Fenotipska karakterizacija ovih divljeg tipa i himernih RV u kulturi tkiva otkrila je da je patogenost određenog RV obrnuto proporcionalna njegovoj sposobnosti replikacije u neuronskim stanicama. Iako se SB replicirao na razinama gotovo 1000 puta nižim od SN, a zamjena TS, L i u SB razinama SN imala je mali utjecaj na kinetiku rasta virusa, dodatna zamjena G ili G plus M u SB odgovarajućim SN genima rezultirala je povećanjem proizvodnje virusa za 1 log, što sugerira da kinetiku replikacije virusne RNA, kao i proizvodnju virusnih čestica, uvelike kontrolira RV G protein. Ovaj zaključak podupiru podaci dobiveni s RV G varijantama koje se razlikuju za jednu aminokiselinu u svojim G proteinima. Patogena varijanta virusa bjesnoće SPBNGAK 194 proizvela je titar virusa u NA stanicama koji je bio 1 log niži od onog koji je proizvela nepatogena varijanta SPBNGAN 194, a analiza PCR-a u stvarnom vremenu pokazala je da su stope transkripcije i replikacije virusne RNA u NA stanicama zaraženim SPBNGAK-om bile 5 i 10 puta veće nego u NA stanicama zaraženim SPBNGAK-om.[ 52 ] Daljnji dokazi za inverznu korelaciju između patogenosti i stope sinteze virusne RNA i proizvodnje virusnih čestica pruženi su miševima zaraženim himernim rekombinantnim virusima u kojima su geni G i M atenuiranog soja SN zamijenjeni genima visoko patogenog soja SB. Ovi eksperimenti otkrili su značajno povećanje patogenosti roditeljskog soja SN koji nosi RV G u odnosu na patogeni soj SB. Patogenost se dodatno povećala kada su i G i M iz SB uvedeni u SN.
Zamjena G ili M ili oba u SN odgovarajućim genima iz SB bila je povezana sa značajnim smanjenjem brzine proizvodnje virusnih čestica, kao i brzine sinteze virusne RNA. Ovi podaci ukazuju na to da i G i M igraju važnu ulogu u patogenezi RV reguliranjem virusne replikacije. Nalaz da zamjena G ili G plus M u SN s G ili G plus M iz SB rezultira umjerenim do jakim smanjenjem transkripcije i replikacije virusne RNA, dok zamjena samog M u SN s M iz SB rezultira jakim povećanjem transkripcije i replikacije virusne RNA, ukazuje na to da RV G također ima važnu regulatornu funkciju u transkripciji/replikaciji virusne RNA, bilo samostalno ili putem interakcije s M proteinom. Mehanizam kojim RV G gen kontrolira sintezu virusne RNA nije poznat. Određene nukleotidne sekvence unutar RV G gena, poput onih koje uključuju kodone za Arg333 i Lys 194, identificirane su kao mete za stanične miRNA. Pokazalo se da prepoznavanje mete od strane staničnih miRNA može rezultirati pozitivnom ili negativnom regulacijom virusne replikacije. [ 53 ] Supstitucije Arg 333 → Glu 333 ili Lys 194 → Ser 194 unutar sekvence gena RV G rezultiraju ukidanjem ciljnih sekvenci miRNA, što je pak povezano sa značajnim povećanjem brzine sinteze virusne RNA [Faber M, Sveučilište Thomas Jefferson, PA, SAD, neobjavljeni podaci], što sugerira da stanične miRNA domaćina također igraju važnu ulogu u regulaciji replikacije RV, kao što je pokazano za druge RNA viruse, uključujući virus vezikularnog stomatitisa i HCV. [ 54 ], [ 55 ]
Regulacija virusne replikacije čini se jednim od važnih mehanizama uključenih u patogenezu RV-a. Kako bi izbjegli imunološki odgovor i očuvali integritet neuronske mreže, patogeni sojevi RV-a, ali ne i atenuirani sojevi, mogu regulirati svoju stopu rasta. Niža stopa replikacije vjerojatno koristi patogenim sojevima RV-a očuvanjem neuronske strukture koju ti virusi koriste za dolazak do središnjeg živčanog sustava. Drugo objašnjenje za nižu stopu replikacije patogenog RV-a jest da, kako bi izbjegao rano otkrivanje od strane imunološkog sustava domaćina, virus održava minimalne razine ekspresije svojih antigena.
Odnos između ekspresije RV G, apoptoze i patogenosti
Dobro je poznato da sojevi virusa ulične bjesnoće koji su značajno patogeniji od sojeva prilagođenih kulturi tkiva eksprimiraju vrlo ograničene razine G i ne induciraju apoptozu do kasne faze infektivnog ciklusa, što sugerira da je patogenost određenog virusnog soja obrnuto proporcionalna ekspresiji RV G i sposobnosti induciranja apoptoze.[ 56 ] Izravni dokazi za korelaciju između razine ekspresije G i opsega apoptoze dobiveni su s rekombinantnim RV SPBNGA-GA, koji je nosio dva identična G gena i prekomjerno eksprimirao RV G.[ 57 ] Morfološke studije neuronskih kultura zaraženih ovim rekombinantnim RV pokazale su da je stanična smrt značajno povećana paralelno s prekomjernom ekspresijom RV G i da je apoptoza glavni mehanizam uključen u smrt posredovanu RV G. Posebno, smanjenje bojenja F-aktina nakon infekcije SPBNGA-GA u skladu je s depolimerizacijom aktinskih filamenata induciranom apoptozom. Nadalje, broj TUNEL-pozitivnih jezgri u neuronima zaraženim SPBNGA-GA bio je značajno povećan u usporedbi s onim u neinficiranim i SPBNGA-inficiranim neuronima. Međutim, mehanizam kojim gen RV G posreduje u procesu apoptotske signalizacije ostaje uglavnom nepoznat. Sugerirano je da ekspresija RV G iznad određenog praga ozbiljno narušava staničnu membranu. Vrlo je vjerojatno da se apoptotičke stanice ne uklanjaju brzo u središnjem živčanom sustavu te stoga podliježu sekundarnoj nekrozi. [ 58 ] S druge strane, infekcija RV-om, a posebno prekomjerna ekspresija proteina RV G, može dovesti do piroptoze, puta stanične smrti sličnog apoptozi koji, za razliku od apoptoze, uključuje aktivaciju kaspaze 1 i time dovodi do nekroze. [ 59 ] Stupanj nekroze ili piroptoze izazvan RV infekcijom vjerojatno igra ključnu ulogu u indukciji antivirusnog imuniteta. Dok apoptotičke stanice održavaju integritet membrane i ne stimuliraju urođeni imunološki odgovor, nekrotične stanice postaju permeabilizirane i luče endogene adjuvanse koji mogu pokrenuti snažan urođeni imunološki odgovor. [ 60 ]
Budući da razina apoptoze/nekroze korelira s imunogenošću RV-a, sugerirano je da imunostimulacijski učinak apoptotičkih/nekrotičnih stanica najvjerojatnije doprinosi stvaranju zaštitnog imunološkog odgovora. Stoga je regulacija ekspresije RV G vrlo vjerojatno važan čimbenik u patogenezi bjesnoće, jer omogućuje preživljavanje i širenje patogenih RV varijanti u živčanom sustavu bez uzrokovanja očitog oštećenja neurona i izaziva zaštitni imunološki odgovor koji bi spriječio infekciju.
Ekspresija RV G može biti regulirana na razini sinteze RNA, posttranslacijske razine ili oboje. Pokazalo se da se razine RV G eksprimirane različitim RV himernim varijantama odražavaju brzinom sinteze virusne RNA, što sugerira da diferencijalna regulacija ekspresije RV G tim varijantama proizlazi iz varijacija u brzini transkripcije virusne mRNA. Kao i kod brzina transkripcije virusne RNA, količina RV G koju eksprimiraju ove varijante obrnuto je proporcionalna virusnoj patogenosti. S druge strane, infekcija primarnih neuronskih kultura s manje patogenom RV varijantom CVS-B2c rezultirala je četverostruko višim razinama G proteina nego infekcija s visoko patogenom varijantom CVS-N2c, unatoč sintezi usporedivih razina G mRNA u obje infekcije. Pulse-chase eksperimenti pokazali su da su više razine G proteina u neuronima zaraženim CVS-B2c uglavnom rezultat niže brzine razgradnje CVS-B2c G proteina u usporedbi s CVS-N2c G proteinom. Međutim, mehanizam koji dovodi do brže proteolitičke razgradnje CVS-N2c G proteina još uvijek nije razjašnjen.
Simptomi bjesnoća
Inkubacija za bjesnoću u prosjeku traje 30-90 dana. U slučaju masovne infekcije kroz velike rane na glavi i licu, može se skratiti na 12 dana. U rijetkim slučajevima inkubacija može trajati godinu dana ili više.
Postoji strogo sekvencijalna izmjena triju razdoblja bolesti: prodromalnog, ekscitacijskog, paralize.
Prodromalno razdoblje započinje pojavom bolne ili vučne boli na mjestu ugriza, kao i boli duž živaca. U području ožiljka može se javiti peckanje, svrbež, ponekad crvenilo i oteklina. Pacijent osjeća opću slabost, glavobolju, mučninu. Primjećuje se povraćanje, porast tjelesne temperature na 37,5-38 °C i simptomi progresivnog mentalnog poremećaja: povećana refleksna razdražljivost, neobjašnjiv osjećaj tjeskobe, straha, melankolije. Često je pacijent depresivan, inhibiran, povučen u sebe, odbija jesti, loše spava, žali se na tmurne misli, zastrašujuće snove. Prodromalno razdoblje traje 2-3 dana, ponekad se produži do 7 dana. Na kraju ovog razdoblja mogu se javiti napadi tjeskobe s kratkotrajnim poteškoćama s disanjem, osjećajem stezanja u prsima, praćenim tahikardijom i ubrzanim disanjem.
Razdoblje uzbuđenja obilježeno je pojavom hidrofobije: pri pokušaju pijenja, a zatim i pri pogledu na vodu ili podsjetniku na nju, pacijent doživljava konvulzivni grč ždrijela i grkljana, tijekom kojeg uz krik baca šalicu vode, drhtavim rukama baca naprijed, zabacuje glavu i tijelo unatrag. Vrat je istegnut, bolna grimasa iskrivljuje lice, koje postaje plavkasto zbog grča dišnih mišića. Oči se ispupče, izražavaju strah, mole za pomoć, zjenice su proširene, udisanje je otežano. Na vrhuncu napada moguć je srčani i respiratorni zastoj. Napad traje nekoliko sekundi, nakon čega se stanje pacijenta čini da se poboljšava. Nakon toga, napadi grčeva mišića grkljana i ždrijela mogu se pojaviti čak i od kretanja zraka (aerofobija), jakog svjetla (fotofobija) ili glasne riječi (akustikofobija). Napadi su popraćeni psihomotornom agitacijom, tijekom koje se pacijent ponaša kao "luđak". Svijest je tijekom napadaja zamagljena, ali se razbistri u interiktalnom razdoblju. Tijekom razdoblja uznemirenosti, zbog povećanog tonusa simpatičkog živčanog sustava, pacijenti doživljavaju naglo povećanje sline (sijaloreju) s nemogućnošću gutanja sline zbog grča faringealnih mišića. Pacijent prska slinu. Neki pacijenti mogu razviti znakove meningizma, pa čak i opistotonusa, a česte su i konvulzije. U tom slučaju, cerebrospinalna tekućina se možda neće promijeniti, ali kod nekih pacijenata može se povećati koncentracija proteina i povećati broj stanica zbog limfocita.
Bez adekvatnog liječenja, znakovi dehidracije se pojačavaju, crte lica postaju oštrije, a tjelesna težina se smanjuje. Tjelesna temperatura raste do visokih vrijednosti. Moguće su konvulzije. Trajanje faze ekscitacije je oko 2-3 dana, rijetko 4-5 dana. Smrtni ishod obično nastupa tijekom jednog od napadaja. Rijetko pacijent preživi do treće faze bolesti.
Tijekom razdoblja paralize, pacijent se smiruje. Napadi hidrofobije prestaju, pacijent može piti i gutati hranu, svijest je bistra. Međutim, unatoč prividnom blagostanju, letargija, apatija, depresija se pojačavaju, paraliza udova, zdjelični poremećaji, ubrzo se javlja paraliza kranijalnih živaca. Tjelesna temperatura raste na 42-43 °C, arterijski tlak pada, a do kraja prvog dana nastupa smrt od paralize kardiovaskularnog i respiratornog centra.
U perifernoj krvi opažaju se neutrofilna leukocitoza, povišeni hemoglobin, eritrociti i hematokrit.
Što vas muči?
Obrasci
Klinički se razlikuju tipični i atipični oblici. Atipični oblici uključuju sve slučajeve bez uzbuđenja i hidrofobije. Atipični oblici uključuju bulbarni, cerebelarni, meningoencefalitički itd.
Dijagnostika bjesnoća
Detekcija antigena bjesnoće, antitijela, virusne RNA ili izolacija virusa omogućuje dijagnozu bjesnoće. Budući da bilo koji pojedinačni test može biti negativan kod pacijenta s bjesnoćom, ponekad su potrebni serijski uzorci seruma za detekciju antitijela protiv bjesnoće, uzorci sline za virusnu kulturu i biopsija kože za izravno imunofluorescentno testiranje na virusni antigen, posebno kada postoji velika sumnja na bjesnoću.
Jedna od najbržih metoda za dijagnosticiranje antemortem bjesnoće kod ljudi je provođenje izravnog imunofluorescentnog testa na biopsiji kože s potiljka kako bi se otkrio antigen bjesnoće. Izravni imunofluorescentni test je najosjetljivija i najspecifičnija metoda za otkrivanje antigena bjesnoće u koži i drugim svježim tkivima (npr. biopsija mozga), iako rezultati povremeno mogu biti negativni u ranoj fazi bolesti. Ako svježe tkivo nije dostupno, enzimska razgradnja fiksiranih tkiva može povećati reaktivnost imunofluorescentnog testa; međutim, osjetljivost može biti neprihvatljivo niska.
Dijagnoza se također može postaviti ako se virus izolira iz sline nakon inokulacije stanica neuroblastoma ili laboratorijskih glodavaca; to je obično najučinkovitije tijekom prva 2-3 tjedna bolesti. Detekcija antitijela koja neutraliziraju virus bjesnoće, obično provedena brzim fluorescentnim fokusnim inhibicijskim testom (RFFIT), u serumu necijepljenih osoba također je dijagnostička. Prisutnost antitijela u cerebrospinalnoj tekućini potvrđuje dijagnozu, ali se mogu pojaviti 2-3 dana kasnije od serumskih antitijela i stoga mogu biti manje korisna u ranim fazama bolesti. Iako se serološki odgovor nakon cijepljenja općenito ne razlikuje od serološkog odgovora izazvanog bolešću, cijepljenje obično ne proizvodi antitijela na cerebrospinalnu tekućinu.
Samo sedam slučajeva "oporavka" od bjesnoće u posljednjih 25 godina dobro je dokumentirano. Iako virus bjesnoće nije izoliran ni od jednog pacijenta, visoki titri antitijela koja neutraliziraju bjesnoću u uzorcima seruma i prisutnost neutralizirajućih antitijela u cerebrospinalnoj tekućini snažno su poduprli dijagnozu.
Što treba ispitati?
Koji su testovi potrebni?
Diferencijalna dijagnoza
Dijagnoza bjesnoće kod ljudi obično se postavlja na temelju epidemioloških i kliničkih podataka i potvrđuje u laboratoriju. Dijagnoza je jednostavna ako postoji anamneza ugriza životinja i ako se pojavio cijeli spektar simptoma i znakova. Inače, prije provođenja specifičnih laboratorijskih testova potrebna je pažljiva, ali brza procjena epidemioloških i kliničkih značajki manje tipičnih slučajeva. Svakog pacijenta s neurološkim znakovima ili simptomima ili neobjašnjivim encefalitisom treba pitati o mogućnosti izloženosti životinjama u endemskim područjima bjesnoće unutar ili izvan zemlje prebivališta. Neuspjeh u sumnji na bjesnoću u nekoliko nedavnih ljudskih smrtnih slučajeva u Sjedinjenim Državama mogao je biti posljedica nedostatka pažljive anamneze izloženosti.
Na početku bolesti, bjesnoća može oponašati mnoge zarazne i nezarazne bolesti. Mnogi drugi encefalitisi, poput onih uzrokovanih herpesvirusima i arbovirusima, nalikuju bjesnoći. Druge zarazne bolesti također mogu oponašati bjesnoću, poput tetanusa, cerebralne malarije, rikecioze i tifusa. Paralitičke zarazne bolesti koje se mogu zamijeniti s bjesnoćom uključuju poliomijelitis, botulizam i herpes simian B encefalitis.
Nezarazne bolesti koje se mogu zamijeniti s bjesnoćom uključuju niz neuroloških sindroma, posebno akutnu upalnu polineuropatiju (Guillain-Barréov sindrom), kao i alergijski postvakcinacijski encefalomijelitis živčanog tkiva uzrokovan cijepljenjem protiv bjesnoće, trovanje ili intoksikaciju drogama, odvikavanje od alkohola, akutnu porfiriju i histeriju uzrokovanu bjesnoćom. Guillain-Barréov sindrom može se zamijeniti za paralitičku bjesnoću i obrnuto.
Tko se može obratiti?
Liječenje bjesnoća
Liječenje bjesnoće nije razvijeno. Primjena velikih doza specifičnog imunoglobulina protiv bjesnoće i leukocitnog interferona je neučinkovita. Simptomatsko liječenje provodi se kako bi se ublažila patnja pacijenta. U tu svrhu pacijent se smješta u zaseban odjel ili boks, stvara se zaštitni režim koji ograničava utjecaj vanjske okoline (smanjena buka, jako svjetlo, protok zraka). Za smanjenje razdražljivosti središnjeg živčanog sustava propisuju se tablete za spavanje, antikonvulzivi i lijekovi protiv bolova. Ravnoteža vode se normalizira.
U paralitičkoj fazi propisuju se lijekovi koji stimuliraju aktivnost kardiovaskularnog i dišnog sustava. Preporučuje se primjena hiperbarične oksigenacije, cerebralne hipotermije, kontroliranog mehaničkog disanja uz potpunu kurarizaciju pacijenta. Međutim, sve metode liječenja praktički su neučinkovite. U najboljem slučaju moguće je produžiti život pacijenta za nekoliko mjeseci. Nepovoljan ishod unaprijed je određen težinom oštećenja moždanog debla s uništavanjem vitalnih centara.
Prevencija
Razvoj prvog cjepiva protiv bjesnoće od strane Pasteura 1885. godine uveo je eru mnogo učinkovitije kontrole bjesnoće. Danas, unatoč gotovo 100%-tnoj stopi smrtnosti ljudi od bjesnoće, bolest se u potpunosti može spriječiti cijepljenjem prije i/ili nakon izlaganja. Dok su Pasteur i njegovi kolege započeli cijepljenje privatnih pasa u Parizu, prvo masovno cijepljenje pasa provedeno je početkom 1920-ih u Japanu, što je označilo prvi veliki nacionalni program kontrole bjesnoće. Oralno cijepljenje divljih životinja, prvi put razvijeno 1970-ih, od tada je više puta pokazalo da učinkovito kontrolira bolest kod glavnih kopnenih domaćina poput lisica, rakuna i tvorova.[ 68 ] Kontinuirano cijepljenje protiv bjesnoće populacija rezervoarskih životinja sa stopom pokrivenosti od 70% ili više na kraju će eliminirati RABV iz rezervoarskih vrsta i spriječiti širenje virusa na slučajne domaćine. [ 69 ]
Filogenetski podaci pokazuju da su lisavirusi zarazili šišmiše mnogo prije nego što su zarazili kopnene sisavce, a većina lisavirusa, uključujući RABV, još uvijek cirkulira u raznim vrstama šišmiša diljem svijeta.[ 70 ] Međutim, učinkovite metode za sprječavanje prijenosa RABV-a među šišmišima ostaju nedostižne, što isključuje mogućnost potpunog iskorjenjivanja bjesnoće u ovom trenutku. Međutim, čak i nakon izlaganja RABV-u putem ugriza sisavca zaraženog bjesnoćom, sigurna i učinkovita postekspozicijska profilaksa (PEP, uključujući čišćenje rana, imunoglobulin protiv bjesnoće i cijepljenje protiv bjesnoće) može zaštititi ljude od infekcije bjesnoćom ako se liječenje provede odmah i u skladu s preporukama Svjetske zdravstvene organizacije (WHO).
Ove dvije metode sprječavanja ljudskih smrti - jedna temeljena na cijepljenju izloženih osoba, a druga na cijepljenju dovoljnog broja pasa kako bi se prekinuo ciklus prijenosa na izvoru - temelj su pristupa "jednog zdravlja" u sprječavanju i kontroli bjesnoće kod pasa. Ova dva različita načina sprječavanja ljudskih smrti razmatrana su kao odvojene alternative: Strategija A, temeljena na pružanju PEP-a ljudima, i Strategija B, temeljena na cijepljenju pasa; ili kao komponente kombinirane Strategije A + B u analizi vjerojatnih troškova alternativnih strategija.[ 71 ]
Zemlje poput Tajlanda postigle su ogroman uspjeh u sprječavanju ljudskih smrti korištenjem PEP-a, ali su također otkrile sve veću potražnju i povezane troškove povezane s korištenjem samo PEP-a. [ 72 ] Na primjer, u usporedbi sa situacijom iz 1991., četiri puta više ljudi (više od 400 000) trebalo je PEP u 2003. Nedavni podaci pokazuju da Narodna Republika Kina, koja cijepi 15 milijuna ljudi godišnje nakon potencijalne izloženosti bjesnoći, troši oko 650 milijuna američkih dolara godišnje samo na PEP. [ 73 ]
Mnogo održiviji pristup je sprječavanje širenja infekcije na izvoru, u životinjskoj populaciji, uz istovremeno povećanje pristupa PEP-u za izložene ljudske pacijente kada je to potrebno. Tamo gdje postoji politička volja i odgovarajuće financiranje za kontrolu bjesnoće kod pasa, smrtni slučajevi mogu se i jesu eliminirani. Široko rasprostranjena upotreba cijepljenja pasa dovela je do eliminacije bjesnoće kod pasa u nekoliko zemalja, uključujući Maleziju 1954., [ 74 ] Japan 1956., Tajvan 1961., Singapur i, posebno, diljem zapadne Europe (pregledano u Rupprecht i sur., King i sur. te Gongal i Wright). [ 75 ]
Использованная литература


 [
[