Medicinski stručnjak članka
Nove publikacije
Uloga promjena u subhondralnoj kosti u patogenezi osteoartritisa
Posljednji pregledao: 04.07.2025

Svi iLive sadržaji medicinski se pregledavaju ili provjeravaju kako bi se osigurala što je moguće točnija činjenica.
Imamo stroge smjernice za pronalaženje izvora i samo povezujemo s uglednim medijskim stranicama, akademskim istraživačkim institucijama i, kad god je to moguće, medicinski pregledanim studijama. Imajte na umu da su brojevi u zagradama ([1], [2], itd.) Poveznice koje se mogu kliknuti na ove studije.
Ako smatrate da je bilo koji od naših sadržaja netočan, zastario ili na neki drugi način upitan, odaberite ga i pritisnite Ctrl + Enter.
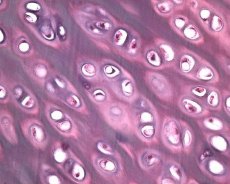
Uz degeneraciju zglobne hrskavice, i podložno koštano tkivo je uključeno u patološki proces kod osteoartroze. Pretpostavlja se da zadebljanje subhondralne ploče doprinosi progresiji osteoartroze. Kako osteoartroza napreduje, zglobna hrskavica, koja je podložna mehaničkom i kemijskom stresu, polako erodira zbog neravnoteže u procesima katabolizma i reparacije hrskavice. Posebno, mehaničko naprezanje u odnosu na zglobove koji "nose" tjelesnu težinu doprinosi stvaranju velikog broja mikrofraktura u subhondralnoj ploči i hrskavici. Kako zglobna hrskavica erodira, napreduje skleroza subhondralne kosti, povećava se krutost koštanog tkiva, što zauzvrat doprinosi daljnjem narušavanju strukture zglobne hrskavice. Međutim, pitanje primarne ili sekundarne prirode promjena subhondralne kosti kod osteoartroze ostaje neriješeno.
Do nedavno su se radiografski uočljive promjene u spužvastoj tvari subhondralne kosti, poput skleroze ili stvaranja cista, smatrale sekundarnima kod pacijenata s osteoartrozom. Međutim, rezultati kliničkih i eksperimentalnih studija ukazuju na moguću inicijacijsku ulogu subhondralne kosti u patogenezi osteoartroze. Jedan od mogućih mehanizama je naglo povećanje gradijenta krutosti subhondralne kosti zbog činjenice da integritet temeljnog hrskavičnog tkiva ovisi o mehaničkim svojstvima njegovog koštanog "ležišta". Studije na primatima pokazale su da promjene u subhondralnoj kosti mogu prethoditi promjenama u zglobnoj hrskavici. Dokazi za i protiv ove hipoteze koji su se pojavili kao rezultat studija na životinjskim modelima osteoartroze i kliničkih studija samo su pojačali raspravu. Zadebljanje trabekula u subhondralnoj kosti nije uvijek popraćeno povećanjem mineralizacije kosti, odnosno povećanjem volumena osteoida. Ovaj znak abnormalne mineralizacije ukazuje na to da je poremećaj regulacije pregradnje kostiju sastavni dio osteoartritisa, a također podupire koncept defekta koštanih stanica kod osteoartritisa. J. Dequekerova grupa (1989.) smatra potonje "generaliziranom metaboličkom bolešću kostiju".
Koštano tkivo se stalno obnavlja. Ovaj dinamički proces, nazvan preoblikovanje kostiju, složen je slijed resorpcije i mineralizacije. Osteoklasti resorbiraju koštano tkivo, a osteoblasti luče proteine koji tvore glavnu organsku komponentu za mineralizaciju. Stvaranje i resorpcija kostiju ne događaju se nasumično kroz cijeli skelet; to je programirani proces koji se odvija u različitim područjima skeleta, nazvanim jedinicama preoblikovanja kostiju. U ranoj fazi ciklusa, osteoklasti se pojavljuju na neaktivnoj površini; unutar 2 tjedna formiraju tunel u kortikalnoj kosti ili lakunu na površini trabekularne kosti. Učestalost aktivacije novih jedinica preoblikovanja kostiju određuje stupanj obnove kostiju. Kod zdrave mlade osobe procesi stvaranja i resorpcije kostiju su uravnoteženi, a održava se normalna koštana masa. U hormonskoj regulaciji resorpcije koštanog tkiva, barem PTH i PGE2 , sudjeluju ne samo osteoklasti već i osteoblasti, budući da se pod utjecajem tih hormona oslobađaju čimbenici koji stimuliraju resorpciju kostiju osteoklastima. Trenutno je poznato više od 12 lokalnih i sistemskih regulatora rasta koštanog tkiva koji utječu na njegovo preoblikovanje, posebno PTH, 1,25(OH)2D3 ,kalcitonin, hormon rasta, glukokortikoidi, hormoni štitnjače, inzulin, IGF (1 i 2), estrogeni, PGE2 , androgeni.
Koštane stanice oslobađaju niz proteina i citokina koji provode endokrinu regulaciju i prijenos signala. Proteini koje proizvode osteoblasti uključuju proteine koštane matrice poput kolagena, osteopontina, osteokalcina, koštanih sijaloproteina. Osim toga, ove stanice oslobađaju proteaze u aktivnom i latentnom obliku koje sudjeluju u procesu pregradnje koštanog tkiva - MMP-ove, komponente sustava aktivatora plazminogena (PA)/plazmina. Citokini koje oslobađaju osteoblasti mogu djelovati i autokrinim mehanizmima i parakrinim putovima na lokalne stanice (drugi osteoblasti, osteoklasti).
Još nije poznato jesu li ti signali regulirani mehaničkim stresom ili drugim kemijskim signalima izazvanim mehaničkim stresom. Međutim, poznato je da ponovljeni mehanički stres uzrokuje lokalnu proliferaciju koštanih stanica i/ili proteina. In vivo, mehaničko opterećenje može aktivirati osteoblaste, povećati razinu cikličkih nukleotida, proizvodnju prostaglandina i uzrokovati morfološke promjene povezane s pregradnjom kostiju. In vitro, mehanički stres uzrokuje proliferaciju kultura osteoblasta, ekspresiju mRNA koštanih proteina uključenih u stvaranje i mineralizaciju osteoida, oslobađanje lokalnih faktora rasta poput IGF-1 i IGF-2 te adhezijskih molekula. Prijenos signala mehaničkog stresa može se provesti putem mehanosenzitivnih ionskih kanala.
Postoje neizravni dokazi o disfunkciji osteoblasta kod osteoartroze. G. Gevers i J. Dequeker (1987.) pokazali su porast razine osteokalcina u serumu kod žena s osteoartrozom šake, kao i u kortikalnim koštanim eksplantatima, što ukazuje na to da patologija kostiju može biti dio osteoartroze. Obdukcija je otkrila ne samo zadebljanje subhondralne kosti, već i abnormalno nisku mineralizaciju glave bedrene kosti. Kod zamoraca s kirurški induciranom osteoartrozom, kompjuterizirana tomografija otkrila je značajno zadebljanje koštane frakcije u subhondralnoj zoni. Neravnoteža između kolagenih i nekolagenih (osteokalcin itd.) proteina može dovesti do povećanja volumena kosti, ali ne utječe na njezinu mineralnu gustoću. Prema M. Shimizu i sur. (1993.), progresija degenerativnih promjena u zglobnoj hrskavici povezana je s intenzivnijim preoblikovanjem subhondralne kosti i povećanjem njezine krutosti, što također ukazuje na defekt u stanicama koštanog tkiva kod osteoartroze. Prema hipotezi koju su predložili B. Lee i M. Aspden (1997.), proliferacija defektnih koštanih stanica može dovesti do povećanja krutosti koštanog tkiva, ali ne uzrokuje povećanje njegove mineralne gustoće.
CI Westacott i sur. (1997.) postavili su hipotezu da abnormalni osteoblasti izravno utječu na metabolizam hrskavice. Uzgojujući osteoblaste pacijenata s osteoartritisom s hondrocitima osoba koje nisu imale bolesti zglobova, autori su in vitro uočili značajnu promjenu u oslobađanju glikozaminoglikana iz normalnog hrskavičnog tkiva, ali razina oslobađanja citokina ostala je nepromijenjena. G. Hilal i sur. (1998.) pokazali su da kultura osteoblasta iz subhondralne kosti pacijenata s osteoartritisom in vitro ima promijenjen metabolizam - aktivnost AP/plazminskog sustava i razina IGF-1 u tim stanicama su povećane. Opažanje CI Westacott i sur. (1997.) može se objasniti povećanjem aktivnosti proteaza u subhondralnim koštanim stanicama.
Ostaje nepoznato potiču li promjene u subhondralnoj kosti osteoartritis ili doprinose njegovom napredovanju. DK Dedrick i sur. (1993.) pokazali su da kod pasa s kirurški induciranim osteoartritisom zadebljanje subhondralne kosti nije nužan uvjet za razvoj promjena sličnih osteoartrozi u zglobnoj hrskavici, ali doprinosi napredovanju degenerativnih procesa u hrskavici. Rezultati studije A. Sa'ied i sur. (1997.) proturječe podacima prethodne studije. Koristeći 50 MHz ehografiju za procjenu početnih morfoloških promjena i njihove progresije u zglobnoj hrskavici i kosti kod eksperimentalnog osteoartritisa induciranog injekcijama monojodooctene kiseline u koljeni zglob štakora, autori su pokazali istovremeni proces promjena u kosti i hrskavici tijekom prva tri dana nakon injekcije.
Osteoblasti luče faktore rasta i citokine uključene u lokalno preoblikovanje kostiju, što može potaknuti preoblikovanje pravilne hrskavice u zglobovima koji "nose težinu" nakon njihovog prodiranja kroz mikropukotine u kalcificiranom sloju zglobne hrskavice. Štoviše, produkti sekrecije koštanih stanica nalaze se u sinovijalnoj tekućini. Najvjerojatniji produkti koje luče abnormalni osteoblasti, a koji mogu pokrenuti proces lokalnog preoblikovanja hrskavice, su TGF-β i proteini morfometrije kostiju (BMP). Oba člana TGF obitelji luče i hondrociti i osteoblasti, a oba su sposobna modificirati preoblikovanje i kosti i hrskavice. J. Martel Pelletier i sur. (1997.) uočili su porast razine TGF-β u subhondralnim koštanim eksplantatima pacijenata s osteoartrozom u usporedbi sa zdravim osobama, što ukazuje na vjerojatnu ulogu ovog faktora rasta u patogenezi osteoartroze. IGF-ove također proizvode osteoblasti. U kulturi stanica sličnih osteoblastima dobivenih od pacijenata s osteoartrozom pronađen je porast razine IGF-ova, koji mijenjaju metabolizam hrskavice.
TGF-b, IGF, BMP i citokini koje proizvode osteoblasti u subhondralnoj kosti mogu utjecati na proizvodnju kolagenaze i drugih proteolitičkih enzima u hrskavici, što zauzvrat može potaknuti preoblikovanje/degradaciju hrskavičnog matriksa. Ostaje nejasno proizvode li osteoblasti u OA manje faktora stimuliranja kolonija makrofaga (M-CSF - stimulator resorpcije kosti) od normalnih stanica. Rezultati studija AG Uitterlindena i suradnika (1997.) pokazali su da receptori vitamina D, koje eksprimiraju osteoblasti i reguliraju ekspresiju niza faktora koje sintetiziraju te stanice, mogu igrati određenu ulogu u stvaranju osteofita, što djelomično objašnjava ulogu osteoblasta u patogenezi ove bolesti.
Uzimajući u obzir rezultate gore navedenih studija, G. Hilal i sur. (1998.), J. Martel-Pelletier i sur. (1997.) predložili su sljedeću radnu hipotezu o odnosu između preoblikovanja subhondralne kosti i vlastite zglobne hrskavice kod osteoartroze. U ranoj ili uznapredovaloj fazi patogeneze OA, proces preoblikovanja koštanog tkiva u subhondralnoj kosti se pojačava. Istovremeno, ponovljeno opterećenje dovodi do lokalnih mikrofraktura i/ili pojave neravnoteže u sustavu IGF/IGF-vezujućeg proteina (IGFBP) zbog abnormalnog odgovora subhondralnih koštanih osteoblasta, što doprinosi njezinoj sklerozi. Potonje pak može doprinijeti pojavi mikrofraktura vlastite hrskavice i oštećenju njezine matrice.
U normalnim uvjetima, ovo oštećenje se popravlja lokalnom sintezom i oslobađanjem IGF-1 i proteina koji veže IGF, koji stimuliraju stvaranje izvanceličnog materijala zglobne hrskavice. Istovremeno, GF-sustav potiče rast subhondralnih koštanih stanica i stvaranje koštane matrice. Anabolička aktivnost IGF-sustava povećana je u subhondralnoj kosti pacijenata s osteoartrozom, dok lokalna aktivacija AP/plazminskog sustava (lokalnog regulatora IGF-sustava) u zglobnoj hrskavici uzrokuje njezine lokalne promjene. U osteoblastima kod osteoartroze, IGF-1 remeti regulaciju AP plazminom tipom pozitivne povratne sprege, stoga može ograničiti preoblikovanje u koštanom tkivu, što u konačnici dovodi do subhondralne skleroze. Dakle, u koštanom i hrskavičnom tkivu, lokalna indukcija IGF-1 i proteaza dovodi, s jedne strane, do oštećenja hrskavice, a s druge strane do subhondralnog zadebljanja kosti, što zauzvrat doprinosi daljnjem oštećenju hrskavice. Neravnoteža između oštećenja hrskavice povezanog sa subhondralnom sklerozom i njezinih reparativnih sposobnosti dovodi do progresivnih promjena u izvanceličnom matičnim tkivu hrskavice i do razvoja osteoartroze. Prema autorima, ova hipoteza također objašnjava sporo napredovanje bolesti.

